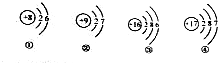
题目内容
7. A、B、C、D、E、F为初中化学常见物质,A、B两溶液发生中和反应,固体C常用于改良酸性土壤,且C和D反应可制得B;E、F的物质类别相同,且F能与A溶液发生反应,已知上述物质间存在如图所示的关系(“→”表示转化关系,“-”表示反应关系).
A、B、C、D、E、F为初中化学常见物质,A、B两溶液发生中和反应,固体C常用于改良酸性土壤,且C和D反应可制得B;E、F的物质类别相同,且F能与A溶液发生反应,已知上述物质间存在如图所示的关系(“→”表示转化关系,“-”表示反应关系).(1)A的物质类别是酸;
(2)F与A反应可能的化学方程式为CuO+2HCl=CuCl2+H2O;
(3)C与D反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)欲通过一步实验证明A,B反应后所得溶液中溶质的成分,需要加入的试剂是紫色石蕊.
分析 根据A、B、C、D、E、F为初中化学常见物质,固体C常用于改良酸性土壤,所以C是氢氧化钙,A、B两溶液发生中和反应,A也会与氢氧化钙反应,所以A是酸,可以是盐酸,所以B是碱,氢氧化钙和D反应会生成碱,所以D是碳酸钠,B就是氢氧化钠,氢氧化钠和盐酸反应生成氯化钠和水,E、F的物质类别相同,且F能与盐酸溶液发生反应,所以F可以是金属氧化物,E是水,然后将推出的物质进行验证即可.
解答 解:(1)A、B、C、D、E、F为初中化学常见物质,固体C常用于改良酸性土壤,所以C是氢氧化钙,A、B两溶液发生中和反应,A也会与氢氧化钙反应,所以A是酸,可以是盐酸,所以B是碱,氢氧化钙和D反应会生成碱,所以D是碳酸钠,B就是氢氧化钠,氢氧化钠和盐酸反应生成氯化钠和水,E、F的物质类别相同,且F能与盐酸溶液发生反应,所以F可以是金属氧化物,E是水,经过验证,推导正确,所以A是酸;
(2)E物质是水,属于氧化物;若F是氧化铜,氧化铜和盐酸反应产生氯化铜和水,反应的方程式为:CuO+2HCl=CuCl2+H2O;
(3)D是碳酸钠,俗名为纯碱;C和D反应是氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)欲通过一步实验证明A、B反应后所得溶液中溶质的组成是氯化钠或氯化钠、盐酸的混合物或氯化钠、氢氧化钠的混合物,可以选用紫色的石蕊试液,看变色情况确定溶液的酸碱性,故填:紫色石蕊试液.
故答案为:(1)酸;
(2)CuO+2HCl=CuCl2+H2O;
(3)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)紫色石蕊试液.
点评 在解此类题时,首先将题中有特征的物质推出,然后结合推出的物质和题中的转化关系推导剩余的物质,最后将推出的各种物质代入转化关系中进行验证即可.

| A. | 3g碳在100g氧气中充分燃烧生成103g二氧化碳 | |
| B. | 100mL98%的浓硫酸用100mL水稀释,可得到溶质质量分数为49%的硫酸 | |
| C. | 用含杂质(杂质不与酸反应,也不溶于水)的铁10g 和50g 稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,则含杂质的铁中铁的质量分数为56% | |
| D. | MgO与CuO的混合物与98g10%的稀硫酸恰好完全反应,则原混合物中氧元素的质量是1.6g |
| A. | 红磷在空气中燃烧产生大量白烟 | |
| B. | 打开盛有浓盐酸的试剂瓶,看到瓶口有大量白雾 | |
| C. | 能使紫色石蕊试液变红色的物质一定是酸 | |
| D. | 取少量氢氧化钠固体曝露在空气中,氢氧化钠固体表面潮湿并逐渐溶解 |
| 选项 | 物质 | 除杂试剂 | 操作方法 |
| A | KCl(KClO3) | MnO2 | 加入适量MnO2,加热使其充分反应 |
| B | NH3(H2O) | 浓硫酸 | 将气体通过盛有足量浓硫酸的洗气瓶 |
| C | CaCl2溶液(HCl) | Ca(OH)2溶液 | 向溶液中加入过量的Ca(OH)2溶液 |
| D | NaCl溶液(BaCl2) | Na2SO4溶液 | 向溶液中加入适量的Na2SO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
 根据所学知识,可以从“电解水实验”中获得的信息和推论.下列说法正确的是( )
根据所学知识,可以从“电解水实验”中获得的信息和推论.下列说法正确的是( )| A. | 水是由氢分子和氧分子构成的 | |
| B. | 水是由氢原子和氧原子直接构成的 | |
| C. | 试管a、b中所得气体的质量比约为2:1 | |
| D. | 试管a、b中所得气体的体积比约为2:1 |
 科技日报北京2015年4月7日电美国华人科学家研制出首款可商业应用的高性能铝电池,其充电更快,寿命更长而且还很便宜,使用这种电池的智能手机充满电仅需一分钟.实验发现,用三维石墨作为电池正极材料,能极大缩短电池的充电时间.原理与铝空气电池相似,铝空气电池以高纯度铝Al(含铝99.99%)为负极、氧为正极,以氢氧化钾或氢氧化钠水溶液为电解质,铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝.铅空气电池的进展十分迅速,是一种很有发展前途的空气电池.请回答有关间题:
科技日报北京2015年4月7日电美国华人科学家研制出首款可商业应用的高性能铝电池,其充电更快,寿命更长而且还很便宜,使用这种电池的智能手机充满电仅需一分钟.实验发现,用三维石墨作为电池正极材料,能极大缩短电池的充电时间.原理与铝空气电池相似,铝空气电池以高纯度铝Al(含铝99.99%)为负极、氧为正极,以氢氧化钾或氢氧化钠水溶液为电解质,铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝.铅空气电池的进展十分迅速,是一种很有发展前途的空气电池.请回答有关间题: