题目内容
6.某课外兴趣小组为测定某硝酸银溶液中溶质的质量分数,取10g硝酸银溶液,向其中逐滴滴加10%的稀盐酸,至不再出现沉淀为止,共用去7.3g的稀盐酸,请回答下列问题:(1)计算该硝酸银溶液中溶质的质量分数.
(2)求配制100g 10%的盐酸溶液需37%的浓盐酸的质量.
分析 (1)利用溶液中溶质质量分数的相关计算,结合化学方程式的有关计算要求进行.
(2)根据溶液稀释前后溶质质量不变解答.
解答 解:
(1)设硝酸银的溶质质量分数为x%
HCl+AgNO3 =HNO3 +AgCl↓
36.5 170
7.3g×10% 10g×x%
$\frac{36.5}{7.3g×10%}=\frac{170}{10g×x%}$
x%=34%
(2)配制100g 10%的盐酸溶液需37%的浓盐酸的质量为:$\frac{100g×10%}{37%}$≈27g
答案:
(1)该硝酸银溶液中溶质的质量分数为34%;
(2)配制100g 10%的盐酸溶液需37%的浓盐酸的质量为27g.
点评 此题是对溶液有关问题计算的设计,涉及到复分解反应进行,是一道较为基础的溶液计算题题目.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
16. 化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:
化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:
表1 NaOH、Na2CO3和NaCl在水中的溶解度(20℃)
表2 NaOH、Na2CO3和NaCl在乙醇中的溶解度(“-”表示几乎不溶)
按照如图装置进行实验:
Ⅰ.向烧杯中加入试剂a.向2支试管中分别加入20mL一定溶质质量分数的氢氧化钠的水溶液(试管1)和20mL饱和的氢氧化钠的乙醇溶液(试管2).
Ⅱ.分别通入适量的二氧化碳.
Ⅲ.再分别滴加稀盐酸.
关于该实验有以下分析与解释:
①通入适量的二氧化碳时试管2中NaOH与CO2反应的化学方程式为2NaOH+CO2═Na2CO3↓+H2O.
②烧杯中出现浑浊,则试剂a为澄清石灰水.
③通入二氧化碳后,试管1、2中的现象明显相同.
④通过上述实验,对于没有明显现象的反应,可以通过证明有新物质的生成来证明反应的发生.
⑤新物质的生成,可以利用化学性质来证明,也可以用其物理性质证明.
以上说法正确的是( )
 化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:
化学实验小组在做二氧化碳和氢氧化钠溶液反应的趣味实验.查阅资料如下:表1 NaOH、Na2CO3和NaCl在水中的溶解度(20℃)
| T/℃ | NaOH | Na2CO3 | NaCl |
| 20 | 109 | 21.8 | 36.0 |
| T/℃ | NaOH | Na2CO3 | NaCl |
| 20 | 17.3 | - | 0.1 |
Ⅰ.向烧杯中加入试剂a.向2支试管中分别加入20mL一定溶质质量分数的氢氧化钠的水溶液(试管1)和20mL饱和的氢氧化钠的乙醇溶液(试管2).
Ⅱ.分别通入适量的二氧化碳.
Ⅲ.再分别滴加稀盐酸.
关于该实验有以下分析与解释:
①通入适量的二氧化碳时试管2中NaOH与CO2反应的化学方程式为2NaOH+CO2═Na2CO3↓+H2O.
②烧杯中出现浑浊,则试剂a为澄清石灰水.
③通入二氧化碳后,试管1、2中的现象明显相同.
④通过上述实验,对于没有明显现象的反应,可以通过证明有新物质的生成来证明反应的发生.
⑤新物质的生成,可以利用化学性质来证明,也可以用其物理性质证明.
以上说法正确的是( )
| A. | ①②③④ | B. | ②③④⑤ | C. | ①②④⑤ | D. | ①②③⑤ |
17.下列说法正确的是( )
| A. | 3g碳在100g氧气中充分燃烧生成103g二氧化碳 | |
| B. | 100mL98%的浓硫酸用100mL水稀释,可得到溶质质量分数为49%的硫酸 | |
| C. | 用含杂质(杂质不与酸反应,也不溶于水)的铁10g 和50g 稀硫酸完全反应后,滤去杂质,所得液体质量为55.4g,则含杂质的铁中铁的质量分数为56% | |
| D. | MgO与CuO的混合物与98g10%的稀硫酸恰好完全反应,则原混合物中氧元素的质量是1.6g |
18.下列记录的实验现象与事实不相符的是( )
| A. | 红磷在空气中燃烧产生大量白烟 | |
| B. | 打开盛有浓盐酸的试剂瓶,看到瓶口有大量白雾 | |
| C. | 能使紫色石蕊试液变红色的物质一定是酸 | |
| D. | 取少量氢氧化钠固体曝露在空气中,氢氧化钠固体表面潮湿并逐渐溶解 |
16.下列选用的除杂试剂括号内为杂质)和实验操作都正确的是(( )
| 选项 | 物质 | 除杂试剂 | 操作方法 |
| A | KCl(KClO3) | MnO2 | 加入适量MnO2,加热使其充分反应 |
| B | NH3(H2O) | 浓硫酸 | 将气体通过盛有足量浓硫酸的洗气瓶 |
| C | CaCl2溶液(HCl) | Ca(OH)2溶液 | 向溶液中加入过量的Ca(OH)2溶液 |
| D | NaCl溶液(BaCl2) | Na2SO4溶液 | 向溶液中加入适量的Na2SO4溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
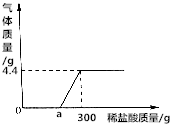 取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.
取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示. 科技日报北京2015年4月7日电美国华人科学家研制出首款可商业应用的高性能铝电池,其充电更快,寿命更长而且还很便宜,使用这种电池的智能手机充满电仅需一分钟.实验发现,用三维石墨作为电池正极材料,能极大缩短电池的充电时间.原理与铝空气电池相似,铝空气电池以高纯度铝Al(含铝99.99%)为负极、氧为正极,以氢氧化钾或氢氧化钠水溶液为电解质,铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝.铅空气电池的进展十分迅速,是一种很有发展前途的空气电池.请回答有关间题:
科技日报北京2015年4月7日电美国华人科学家研制出首款可商业应用的高性能铝电池,其充电更快,寿命更长而且还很便宜,使用这种电池的智能手机充满电仅需一分钟.实验发现,用三维石墨作为电池正极材料,能极大缩短电池的充电时间.原理与铝空气电池相似,铝空气电池以高纯度铝Al(含铝99.99%)为负极、氧为正极,以氢氧化钾或氢氧化钠水溶液为电解质,铝摄取空气中的氧,在电池放电时产生化学反应,铝和氧作用转化为氧化铝.铅空气电池的进展十分迅速,是一种很有发展前途的空气电池.请回答有关间题: