题目内容
13.小刚、小军、小红对一久置的NaOH白色粉末的成分进行探究并测定其成分的含量.(一)成分的确定
三位同学都作出以下的猜想:
①可能是NaOH; ②可能是Na2CO3; ③可能是NaOH与Na2CO3的混合物.
(1)做出②③猜想的依据是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示)
(2)为了验证①②③猜想,他们分别做了下面的实验.
小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有Na2CO3,肯定猜想①(填序号)是错误的.
小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军结合小刚的实验,认为猜想③是正确的.小红却认为小军的所得结论不确切,因为Na2CO3显碱性也会使酚酞试液变红.
(3)为探究白色粉末是否含有NaOH,小红设计了如图1所示实验方案:

①沉淀B的化学式为CaCO3.
②在操作1中要用到玻璃棒,其作用是搅拌;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是漏斗.
③小刚认为小红的这个方案也有问题,理由是Na2CO3与Ca(OH)2反应后也有NaOH生成. 但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2 或Ca(NO3)2或BaCl2).小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定猜想③是正确的.
(二)各成分含量的测定
三位同学利用电子天平共同作了如图2所示测定实验.
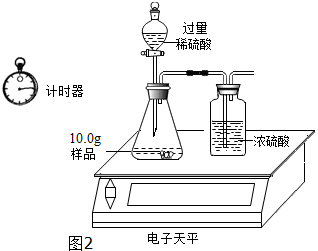
实验数据记录如表:
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
(5)试通过分析表中数据计算出混合物中试样中各成份的质量分数,NaOH47%,Na2CO353%.
(三)实验反思:
(1)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是CO2密度比空气大,会有CO2残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小.(或浓硫酸会吸收空气中的水份,造成最终测得的质量偏大,测得生成的CO2质量偏小.)(实验操作均正确).
(2)根据反应的化学方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗硫酸的量相等(填“相等”、“大于”或“小于”)
分析 根据题设条件,按步分析,逻辑推理,层层推进,“对号入座”,得出结论.
解题时注意:(1)思维过程展示注意逻辑性;(2)发散性结论(几种可能组合)按序排列分析,防止遗漏或重复;(3)表述要清楚
氢氧化钠能与二氧化碳费用生成碳酸钠,碳酸钠的水溶液呈碱性,能使酚酞试液变红;检验碳酸钠可以使用酸或含有可溶性钙离子的物质;碳酸钠和氢氧化钠同时存在,检验氢氧化钠,需要先除去碳酸钠,并且不能生成氢氧化钠,据此解答.
解答 解:一、成分的确定
由于久置的氢氧化钠可能与空气中的二氧化碳反应生成碳酸钠和水,该反应的化学方程式为:CO2+2NaOH═Na2CO3+H2O.因此能作出题干中的三种猜想.
(1)由于碳酸钠与稀盐酸反应时有气泡产生,因此向固体中加入稀盐酸,若观察到有气泡产生,就能说明固体中含有碳酸钠.若固体中含有碳酸钠,就能说明猜想①是错误的.
(2)溶液中存在Na2CO3也会使酚酞变红,因此无色酚酞试液变红时,不能说明一定含有氢氧化钠.说明小军的结论不确切,甚至有可能是错误的.
(3)向白色粉末中加水,粉末会溶解,为加速溶解,可以用玻璃棒搅拌,从而得到溶液A.因此操作1是溶解,在该操作中玻璃棒所起的作用是“搅拌,加速溶解”.
由于粉末中的物质至多有氢氧化钠和碳酸钠,其中氢氧化钠与石灰水不反应,碳酸钠能与石灰水反应生成白色沉淀碳酸钙,因此通过这一操作和现象,可以确定粉末中一定含有碳酸钠,沉淀B一定是碳酸钙.碳酸钙的化学式为CaCO3.
由于Na2CO3与Ca(OH)2反应后也有NaOH生成,因此这个方案不能证明白色粉末中是否含有NaOH.
改进方案:将滴加澄清石灰水改为过量的CaCl2即可.
二、各成分含量的确定
(1)通过以上的分析可知:白色粉末中含有氢氧化钠和碳酸钠.
稀硫酸与氢氧化钠反应生成硫酸钠和水.
该反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
稀硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳.
该反应的化学方程式为:Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
(2)生成二氧化碳的质量为:241.20g+10.00g-249.00g=2.20g
设样品中碳酸钠的质量分数为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
10.00g×x 2.20g
$\frac{106}{10.00g×x}=\frac{44}{2.20g}$
x=53%
NaOH占:1-53%=47%
【实验反思】CO2密度比空气大,会有CO2残留在装置中,造成最终称得的质量偏大,使计算出的CO2质量偏小(或浓硫酸会吸收空气中的水分,造成最终称得的质量偏大,使计算出的CO2质量偏小).
故答案为:
一、成分的确定
CO2+2NaOH═Na2CO3+H2O
(1)Na2CO3 ①
(2)溶液中存在Na2CO3也会使酚酞变红
(3)①CaCO3
②搅拌,加速溶解;
③Na2CO3与Ca(OH)2反应后也有NaOH生成
改进方案:将滴加澄清石灰水改为过量的CaCl2.
二、各成分含量的确定
(1)方程式为2NaOH+H2SO4═Na2SO4+2H2O
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
(2)样品中Na2CO353%;
【实验反思】(1)CO2密度比空气大,会有CO2残留在装置中,造成最终称得的质量偏大,使计算出的CO2质量偏小;
(2)根据化学方程式2NaOH+H2SO4═Na2SO4+2H2O;
CO2+2NaOH═Na2CO3+H2O
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
可知NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗硫酸的量相等.
答案:(1)CO2+2NaOH═Na2CO3+H2O
(2)Na2CO3;①; Na2CO3显碱性也会使酚酞试液变红
(3)①CaCO3; ②搅拌;漏斗;
③Na2CO3与Ca(OH)2反应后也有NaOH生成;将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2 或Ca(NO3)2或BaCl2);
(4)2NaOH+H2SO4═Na2SO4+2H2O;Na2CO3+H2SO4═Na2SO4+H2O+CO2↑;
(5)47%;53%;
【实验反思】(1)CO2密度比空气大,会有CO2残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小.(或浓硫酸会吸收空气中的水份,造成最终测得的质量偏大,测得生成的CO2质量偏小.)
(2)相等.
点评 本题主要考查利用氢氧化钠和碳酸钠的化学性质确定久置的氢氧化钠的成分、利用浓稀硫酸的性质计算久置氢氧化钠中各成分的质量分数,难度较大.

 名校课堂系列答案
名校课堂系列答案| 序号 | (1) | (2) | (3) | (4) | (5) | (6) |
| 名称 | 氧化亚铁 | 铅 | 硝酸 | 纯碱 | 氨水 | 葡萄 |
| 化学式 | FeO | Pb | HNO3 | Na2CO3 | NH3•H2O | C6H12O6 |
| 类别 | 氧化物 | 单质 | 酸 | 盐 | 碱 | 有机物 |
| A. | 禁止焚烧农作物秸秆和垃圾 | B. | 大力植树造林 | ||
| C. | 大力发展煤炭发电 | D. | 用清洁能源代替化石燃料 |
| A. | 用过滤的方法分离NaCl和KNO3的混合物 | |
| B. | 向某无色未知溶液中加入BaCl2溶液,产生白色沉淀,证明存在Ag+ | |
| C. | 将H2、O2混合气体通过盛有灼热氧化铜的试管,以除去氢气 | |
| D. | 用稀硫酸除去混在铜粉中的少量氧化铜粉末 |
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.(1)某矿泉水的主要矿物质成分及含量如下表:
| 成分 | Ca | K | Mg | Na |
| 含量(mg/L) | ≥4 | ≥0.4 | ≥0.5 | ≥0.8 |
(2)如图是某同学自制的简易净水器.其中放置物质的顺序有错误,为使净水效果最佳,请仿照自来水生产流程帮他按由上到下的顺序重新排列BADC(填字母).
(3)下列做法会造成水体污染的有A(填序号).
A.工业废水直接排放 B.生活污水集中处理后排放
C.禁止使用含磷洗衣粉 D.合理使用化肥、农药
(4)目前,人类以化石燃料为主要能源,化石燃料有煤、石油和天然气,它们都属于不可再生(填“可再生”或“不可再生”)能源.天然气的主要成分是甲烷(CH4),写出甲烷在空气中完全燃烧的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.

