题目内容
17.通过一年的化学学习,我们熟悉了许多物质.请从①氯化钠 ②氢氧化钙Ca(OH)2 ③活性炭C ④氯化铵NH4Cl中,选取相应物质的序号填空:(1)能用来做氮肥的是④;(2)有吸附作用的是③;
(3)常用于食品调味的是①;(4)可用于改良酸性土壤的是②.
分析 物质的性质决定物质的用途,根据常见化学物质的性质和用途进行分析解答即可.
解答 解:(1)氮肥必须含有氮元素,所各物质中只有氯化铵中含有氮元素,可做氮肥;
(2)活性炭具有疏松多孔的结构,具有很强的吸附性;
(3)氯化钠有咸味,常用于食品调味品;
(4)氢氧化钙属于碱,能与酸反应生成盐和水,并且价格便宜常用来改良酸性土壤.
故答案为:(1)④;(2)③;(3)①;(4)②.
点评 本题难度不大,物质的性质决定物质的用途,掌握常见化学物质的性质和用途是正确解答此类题的关键.

练习册系列答案
相关题目
5.下列应用对应的化学方程式及基本反应类型正确的是 ( )
| A. | 用熟石灰中和硫酸厂的废水Ca(OH)2+H2SO4═CaSO4+2H2O 中和反应 | |
| B. | 生石灰作干燥剂CaO+H2O═Ca(OH)2 化合反应 | |
| C. | 用氢氧化钠溶液吸收二氧化碳2NaOH+CO2═Na2CO3+H2O 复分解反应 | |
| D. | 高炉炼铁4CO+Fe3O4═4CO2+3Fe 置换反应 |
12.陈去下列物质中的杂质,所选用试剂及操作方法有错误的是( )
| 选项 | 物质 | 杂质(少量) | 试剂及操作方法 |
| A | CO2 | CO | 通过灼热的氧化铜 |
| B | BaCl2 溶液 | HCl | 过量的碳酸钡,过滤 |
| C | O2 | 水蒸气 | 通过浓硫酸 |
| D | MnO2 | KCl | 加入足量水溶解,过滤,将滤液蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
9.复印机复印资料时,常能闻到-股特殊的气味,这种气味就是臭氧的气味.氧气在放电的条件下可以转化为臭氧.下列与此相关的说法中正确的是( )
| A. | 该变化是物理变化 | B. | 该变化是化学变化 | ||
| C. | 臭氧与氧气是同一种物质 | D. | 臭氧与氧气化学性质相同 |
13.小刚、小军、小红对一久置的NaOH白色粉末的成分进行探究并测定其成分的含量.
(一)成分的确定
三位同学都作出以下的猜想:
①可能是NaOH; ②可能是Na2CO3; ③可能是NaOH与Na2CO3的混合物.
(1)做出②③猜想的依据是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示)
(2)为了验证①②③猜想,他们分别做了下面的实验.
小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有Na2CO3,肯定猜想①(填序号)是错误的.
小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军结合小刚的实验,认为猜想③是正确的.小红却认为小军的所得结论不确切,因为Na2CO3显碱性也会使酚酞试液变红.
(3)为探究白色粉末是否含有NaOH,小红设计了如图1所示实验方案:

①沉淀B的化学式为CaCO3.
②在操作1中要用到玻璃棒,其作用是搅拌;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是漏斗.
③小刚认为小红的这个方案也有问题,理由是Na2CO3与Ca(OH)2反应后也有NaOH生成. 但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2 或Ca(NO3)2或BaCl2).小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定猜想③是正确的.
(二)各成分含量的测定
三位同学利用电子天平共同作了如图2所示测定实验.
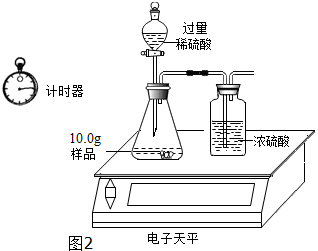
实验数据记录如表:
(4)写出锥形瓶中发生反应化学方程式:2NaOH+H2SO4═Na2SO4+2H2O;Na2CO3+H2SO4═Na2SO4+H2O+CO2↑.
(5)试通过分析表中数据计算出混合物中试样中各成份的质量分数,NaOH47%,Na2CO353%.
(三)实验反思:
(1)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是CO2密度比空气大,会有CO2残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小.(或浓硫酸会吸收空气中的水份,造成最终测得的质量偏大,测得生成的CO2质量偏小.)(实验操作均正确).
(2)根据反应的化学方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗硫酸的量相等(填“相等”、“大于”或“小于”)
(一)成分的确定
三位同学都作出以下的猜想:
①可能是NaOH; ②可能是Na2CO3; ③可能是NaOH与Na2CO3的混合物.
(1)做出②③猜想的依据是CO2+2NaOH═Na2CO3+H2O(用化学方程式表示)
(2)为了验证①②③猜想,他们分别做了下面的实验.
小刚取少量白色粉末于试管中,再滴加稀HCl,有气泡产生,由此可推出白色粉末中一定含有Na2CO3,肯定猜想①(填序号)是错误的.
小军又取少量白色粉末溶于水,向所得溶液中滴加酚酞试液,溶液变为红色.由此小军结合小刚的实验,认为猜想③是正确的.小红却认为小军的所得结论不确切,因为Na2CO3显碱性也会使酚酞试液变红.
(3)为探究白色粉末是否含有NaOH,小红设计了如图1所示实验方案:

①沉淀B的化学式为CaCO3.
②在操作1中要用到玻璃棒,其作用是搅拌;在操作2中,除要用到铁架台(带铁圈)、烧杯、滤纸、玻璃棒外,还需补充的玻璃仪器是漏斗.
③小刚认为小红的这个方案也有问题,理由是Na2CO3与Ca(OH)2反应后也有NaOH生成. 但只要稍加改进,就可以证明粉末中还含有NaOH,则小刚改进的方法是将滴加澄清石灰水改为过量的CaCl2(或Ba(NO3)2 或Ca(NO3)2或BaCl2).小刚对小红的实验作了正确的改进后进行了实验,实验现象和小红的一致,由此确定猜想③是正确的.
(二)各成分含量的测定
三位同学利用电子天平共同作了如图2所示测定实验.

实验数据记录如表:
| 称 量 项 目 | 称 量 时 间 | 质量(g) |
| 试样 | 10.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 249.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 249.00 |
(5)试通过分析表中数据计算出混合物中试样中各成份的质量分数,NaOH47%,Na2CO353%.
(三)实验反思:
(1)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是CO2密度比空气大,会有CO2残留在装置中,造成最终测得的质量偏大,测得生成的CO2质量偏小.(或浓硫酸会吸收空气中的水份,造成最终测得的质量偏大,测得生成的CO2质量偏小.)(实验操作均正确).
(2)根据反应的化学方程式分析,NaOH部分变质或全部变质,与没有变质的NaOH相比,中和反应时消耗硫酸的量相等(填“相等”、“大于”或“小于”)