题目内容
6.实验探究让化学更具魅力,请帮助完成下列实验探究(1)同学们在做完“二氧化碳的实验室制取”后,对废液进行了如下处理:过滤,取滤液于烧杯中,逐滴
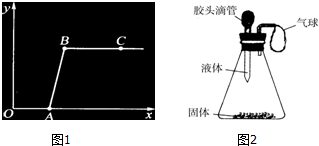
滴入Na2CO3溶液至过量.记录滴入Na2CO3溶液质量(x)与有关的变化关系如图1所示.图中纵坐标(y)
表示生成沉淀的质量,AB段发生反应的化学方程式是CaCl2+Na2CO3=CaC03↓+2NaCl,反应进行到A点时,溶液中的溶质是NaCl、CaCl2,
(2)如图2所示,一同学挤压胶头滴管中的液体,使之与瓶中固体接触,小气球鼓了起来.请写出符合这一现
象的化学方程式:
①置换反应Zn+2HCl=ZnCl2+H2↑;
②化合反应CaO+H2O=Ca(OH)2;
(3)将(NH4)2SO4和Na2CO3两种溶液充分混合加热,发现有气泡产生且闻到刺激性气味,同学们对气体成分产生兴趣.
【查阅】CuO和NH3加热时发生反应:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
【猜想】猜想一:气体是CO2 猜想二:气体是NH3猜想三:气体是NH3和CO2
【讨论 ①猜想一肯定不正确,理由是CO2无刺激性气味;
②因Na2CO3溶液呈碱(填“酸”或“碱”)性,故有NH3产生.
【探究】为确定气体成分,设计如图3装置(夹持装置未画出):

①实验后,取少量A中固体,加入稀盐酸,观察到有气泡产生,证明其中含CO2;
②B中观察到黑色固体变为红色,证明含有NH3;
③根据探究结果,写出(NH4)2SO4和Na2CO3两种溶液发生反应的方程式为:(NH4)2SO4+Na2CO3═Na2SO4+H2O+CO2↑+2NH3↑;
④若B装置连同固体质量减轻4.8g,则C装置增加的质量为5.4g.
【反思】(1)实验测得装置C增加的质量大于理论值,可能的原因是装置C吸收了空气中的水蒸气和二氧化碳;
(2)氨气也是污染物,在C装置后连接图4装置,以吸收尾气中未参加反应的氨气.干燥管的作用是B(填序号)
A.防止氨气逸出 B.防止液体倒吸 C.防止盐酸挥发.
分析 (1)根据碳酸钠与稀盐酸和氯化钙的混合溶液的反应原理进行分析,向混合溶液中逐滴滴入Na2CO3溶液至过量.刚开始时,碳酸钠与稀盐酸反应生成气体;当盐酸反应完后,加入的碳酸钠与氯化钙反应生成了碳酸钙沉淀,所以,图中纵坐标(y)应该表示生成的沉淀质量.当反应进行到B点时,表明反应完全结束,再加入的碳酸钠是过量的,溶液显碱性.据此进行分析解答.
(2)根据小气球鼓起来的是锥形瓶中的气压增大导致的,再结合哪些反应会使瓶内的压强增大进行分析.
(3)【讨论】
二氧化碳是无色、无味的气体;
碳酸钠属于盐,水溶液显碱性;
【探究】
二氧化碳能和氢氧化钠反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
根据实验现象可以判断气体中是否含有氨气;
根据反应物、生成物、质量守恒定律及其反应条件可以书写反应的化学方程式;
B装置连同固体质量减轻4.8g,说明氧化铜中的4.8g氧元素和氢元素结合生成水,根据水的组成可以计算水的质量,水的质量即为则C装置增加的质量;
【反思】
C装置中的碱石灰可以吸收空气中的二氧化碳和水蒸气;
干燥管有较大的体积,可以防止液体倒吸.
解答 解:(1)根据碳酸钠与稀盐酸和氯化钙的混合溶液的反应原理,向混合溶液中逐滴滴入Na2CO3溶液至过量.刚开始时,碳酸钠与稀盐酸反应生成气体;溶液中应先冒气泡,而不是先产生沉淀.发生的反应是:Na2CO3+2HCl=2NaCl+H2O+CO2↑;所以,图中纵坐标(y)应该表示生成的沉淀质量;当盐酸完全反应后,反应进行到A点,此时溶液的溶质是NaCl、CaCl2;再加入的碳酸钠能与氯化钙反应生成了碳酸钙沉淀,所以,AB段发生的反应是:CaCl2+Na2CO3=CaC03↓+2NaCl.
(2)由题意可知可知,小气球胀大是由于锥形瓶中的压强增大产生的:
①置换反应置换反应是单质和化合物生成单质和化合物的反应,铁和盐酸反应生成氯化亚铁和氢气,会使压强增大,所以,反应的方程式:Fe+2HCl=FeCl2+H2↑;
②化合反应,氧化钙能与水化合生成氢氧化钙,放出大量的热,能使锥形瓶中的压强增大.所以,反应的方程式是:CaO+H2O=Ca(OH)2.
(3)【讨论】①猜想一肯定不正确,理由是CO2无刺激性气味.
②因Na2CO3溶液呈碱性,故有NH3产生.
故填:碱.
【探究】
①实验后,取少量A中固体,加入稀盐酸,观察到有气泡产生,说明固体中含有碳酸钠,进一步证明其中含CO2.
故填:有气泡产生.
②B中观察到黑色固体变为红色,证明气体中含有NH3.
故填:黑色固体变为红色.
③(NH4)2SO4和Na2CO3两种溶液发生反应生成硫酸钠、水、二氧化碳和氨气,反应的方程式为:(NH4)2SO4+Na2CO3═Na2SO4+H2O+CO2↑+2NH3↑.
故填:(NH4)2SO4+Na2CO3═Na2SO4+H2O+CO2↑+2NH3↑.
(4)设生成水的质量为x,
若B装置连同固体质量减轻4.8g,说明有4.8g氧元素和氢元素结合生成了水,
x×$\frac{16}{18}$×100%=4.8g,
x=5.4g.
故填:5.4g.
则C装置增加的质量为 5.4g;
【反思】
(1)实验测得装置C增加的质量大于理论值,可能的原因是装置C吸收了空气中的水蒸气和二氧化碳.
故填:装置C吸收了空气中的水蒸气和二氧化碳.
(2)干燥管的作用是防止液体倒吸.
故答案为:
(1)生成沉淀的质量;CaCl2+Na2CO3=CaC03↓+2NaCl;A点溶质是NaCl、CaCl2;
(2)①Zn+2HCl=ZnCl2+H2↑;②CaO+H2O=Ca(OH)2;
(3)【讨论】①CO2无刺激性气味;②碱;
【探究】①有气泡产生;
②黑色固体变为红色;
③(NH4)2SO4+Na2CO3═Na2SO4+H2O+CO2↑+2NH3↑.
④5.4g;
【反思】
(1)装置C吸收了空气中的水蒸气和二氧化碳;
(2)B.
点评 此类题的综合性较强,难度稍大.在解此类题时,要根据物质的性质、反应的原理,分析现象、判断物质、写出有关的方程式等.实验现象是物质之间相互作用的外在表现,因此要学会设计实验、观察实验、分析实验,为揭示物质之间相互作用的实质奠定基础.

| A. | 电子数 | B. | 质子数 | C. | 中子数 | D. | 最外层电子数 |
| A. | 石墨做电极 | B. | 干冰用作制冷剂 | ||
| C. | 浓硫酸作干燥剂 | D. | 铁粉用作食品保鲜吸氧剂 |

 小科以化合价为纵坐标、以物质类别为横坐标绘制了如图,每种物质中都有一种元素的化合价与纵坐标的数值对应,图中字母均表示初中科学中的常见物质,其中“→”表示物质间的转化关系.已知A为硫的氧化物且氧元素的质量分数为60%,C、D、E、F均含有铜元素.请回答:
小科以化合价为纵坐标、以物质类别为横坐标绘制了如图,每种物质中都有一种元素的化合价与纵坐标的数值对应,图中字母均表示初中科学中的常见物质,其中“→”表示物质间的转化关系.已知A为硫的氧化物且氧元素的质量分数为60%,C、D、E、F均含有铜元素.请回答:
 现有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,请列式计算,无需答
现有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,请列式计算,无需答  化学与生活、生产密切相关.请回答下列问题:
化学与生活、生产密切相关.请回答下列问题: