题目内容
17.碳酸氢铵是一种常用的化肥,受热易分解.在一定条件下发生如下反应:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+X↑.(1)化学方程式中X的化学式为CO2.
(2)NH3中氮元素的化合价为-3.
(3)碳酸氢铵应避光,放在阴冷处保存.
分析 (1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式;
(2)根据在化合物中,正负化合价的代数和为零,进行解答.
(3)根据碳酸氢铵的化学性质进行分析解答;
解答 解:(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+X↑,反应前氮、氢、碳、氧原子个数分别为1、5、1、3,反应后的生成物中氮、氢、碳、氧原子个数分别为1、5、0、1,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和2个氧原子构成,则物质X的化学式为CO2.
(2)根据在化合物中,正负化合价的代数和为零,可得氨(NH3)中氮元素的化合价为:x+(+1)×3=0,x=-3;
(3)碳酸氢铵易分解,化学性质不稳定,故应避光,放在阴冷处保存;
(1)CO2;(2)-3;(3)避光,放在阴冷处.
点评 本题难度不大,利用化学反应前后原子守恒来确定物质的化学式是正确解答此类题的关键.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案
相关题目
7.氧化镁在医药、建筑等行业应用广泛.以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于酸)为原料制备高纯氧化镁的实验流程如图:
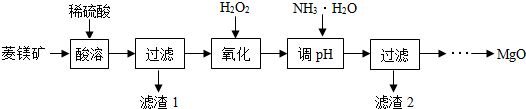
(1)酸溶之前要将矿石粉碎的目的是增大接触面积,使反应更快更充分.稀硫酸需要过量的目的是将碳酸镁和碳酸亚铁完全反应.酸溶步骤中碳酸镁溶解的反应方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如表:
流程“氧化”一步中H2O2的作用是将溶液中的Fe2+转化成Fe3+,不能直接沉淀Fe2+的原因是防止Mg2+沉淀.
(3)加氨水调节溶液的PH范围为控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀.
(4)滤渣2的化学式是Fe(OH)3.

(1)酸溶之前要将矿石粉碎的目的是增大接触面积,使反应更快更充分.稀硫酸需要过量的目的是将碳酸镁和碳酸亚铁完全反应.酸溶步骤中碳酸镁溶解的反应方程式为MgCO3+H2SO4═MgSO4+CO2↑+H2O.
(2)已知Mg2+、Fe2+和Fe3+在溶液中遇到氨水均可以转化成难溶性碱沉淀,开始沉淀和沉淀完全的pH如表:
| Mg2+ | Fe2+ | Fe3+ | |
| 开始沉淀 | 9.4 | 7.9 | 2.7 |
| 沉淀完全 | 12.4 | 9.6 | 3.7 |
(3)加氨水调节溶液的PH范围为控制反应只生成氢氧化铁沉淀而不生成氢氧化镁沉淀.
(4)滤渣2的化学式是Fe(OH)3.
8. 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
已知:白磷的着火点为 40℃.
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;.
(2)实验中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达着火点、未与氧气接触; 推入H2O2溶液后,观察的现象是D(填序号).
A.燃烧匙内白磷、水中白磷均燃烧 B.燃烧匙内白磷、水中白磷均不燃烧
C.燃烧匙内白磷燃烧、水中白磷不燃烧 D.燃烧匙内白磷不燃烧、水中白磷燃烧
(3)实验2中,推入H2O2溶液后,观察到硫磺燃烧得更剧烈,发出蓝紫色 火焰,由此得出氧气的性质是支持燃烧;硫磺熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是先变大后变小.
 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为 40℃.
| 内容 步骤 | 【实验 1】研究燃烧条件 | 【实验 2】研究氧气性质 |
Ⅰ | 烧杯中盛有 80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有 NaOH 溶液,燃烧匙中放入硫磺,点燃硫后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(2)实验中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达着火点、未与氧气接触; 推入H2O2溶液后,观察的现象是D(填序号).
A.燃烧匙内白磷、水中白磷均燃烧 B.燃烧匙内白磷、水中白磷均不燃烧
C.燃烧匙内白磷燃烧、水中白磷不燃烧 D.燃烧匙内白磷不燃烧、水中白磷燃烧
(3)实验2中,推入H2O2溶液后,观察到硫磺燃烧得更剧烈,发出蓝紫色 火焰,由此得出氧气的性质是支持燃烧;硫磺熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是先变大后变小.
5.向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入m克Zn,充分反应后过滤,将滤渣洗涤、干燥后再称量,得到固体质量仍为m克.据此,下列说法正确的是( )
| A. | 取反应后的滤液观察,滤液不可能呈蓝色 | |
| B. | 取反应后的滤液滴加稀盐酸,有白色沉淀产生 | |
| C. | 取滤渣滴加稀硫酸,一定无气泡产生 | |
| D. | 滤渣中的物质至少有两种 |
12.在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
【查阅资料】I.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
【实验探究】同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验.请填写表中空格.
【结论与反思】(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成Na2Cu(OH)4,反应的化学方程式是2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色.
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
【查阅资料】I.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
【实验探究】同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验.请填写表中空格.
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色.
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
9. 小敏发现家中炒过咸菜后未及时清洗的铁锅,比洗净未擦干的铁锅更易生锈.难道是在有盐存在的条件下铁生锈的速度加快了吗?小敏针对问题展开了探究.
小敏发现家中炒过咸菜后未及时清洗的铁锅,比洗净未擦干的铁锅更易生锈.难道是在有盐存在的条件下铁生锈的速度加快了吗?小敏针对问题展开了探究.
(1)铁生锈的本质是铁与氧气和水反应的结果.
【提出猜想】有盐存在的条件下,铁生锈的速度会加快吗?
【设计实验】请设计实验证明自己的猜想,并填写下列实验报告.
(2)工业生产中用稀盐酸除去铁质器械表面的铁锈,请写出除锈的化学方程式6HCl+Fe2O3═2FeCl3+3H2O.
【进一步探究】铁生锈的速度还与哪些因素有关?
【实验设计】小敏设计了如图所示实验探究影响铁生锈速率的因素.
(3)经过几天的观察发现,A瓶铁钉表面先出现红色物质.
【实验结论】(4)铁生锈的速率还与氧气浓度有关.
【进一步猜想】(5)你认为影响铁生锈速率的因素还可能有温度(合理均可)(填一种即可).
【拓展与延伸】在查阅资料后,小敏设计了一组实验探究空气中二氧化碳及有酸存在条件下铁生锈的情况.实验记录如下:
(6)分析以上实验,二氧化碳会促进铁的生锈,请结合以上实验和你学过的知识大胆分析其原因,你的分析是由上述实验现象可知:除去二氧化碳的潮湿空气比潮湿的空气生锈少,而铁生锈需要氧气和水,实验1、2均具备,从而说明二氧化碳会促进铁生锈.
(7)除此之外,你还能从以上实验中得到的信息有(答一点即可):酸能更快促进铁生锈(合理均可).
 小敏发现家中炒过咸菜后未及时清洗的铁锅,比洗净未擦干的铁锅更易生锈.难道是在有盐存在的条件下铁生锈的速度加快了吗?小敏针对问题展开了探究.
小敏发现家中炒过咸菜后未及时清洗的铁锅,比洗净未擦干的铁锅更易生锈.难道是在有盐存在的条件下铁生锈的速度加快了吗?小敏针对问题展开了探究.(1)铁生锈的本质是铁与氧气和水反应的结果.
【提出猜想】有盐存在的条件下,铁生锈的速度会加快吗?
【设计实验】请设计实验证明自己的猜想,并填写下列实验报告.
| 实验步骤 | 可能出现的现象 | 实验结论 |
| 取两支试管分别放入等体积的蒸馏水、加入食盐的蒸馏水,并分别放入洁净无锈的铁钉,浸入一半,静置一段时间 | 放入食盐水的铁钉先生锈,且生锈多 | 盐能加快铁生锈的速度 |
【进一步探究】铁生锈的速度还与哪些因素有关?
【实验设计】小敏设计了如图所示实验探究影响铁生锈速率的因素.
(3)经过几天的观察发现,A瓶铁钉表面先出现红色物质.
【实验结论】(4)铁生锈的速率还与氧气浓度有关.
【进一步猜想】(5)你认为影响铁生锈速率的因素还可能有温度(合理均可)(填一种即可).
【拓展与延伸】在查阅资料后,小敏设计了一组实验探究空气中二氧化碳及有酸存在条件下铁生锈的情况.实验记录如下:
| 编号 | 实验条件 | 放置条件 | 实验现象 |
| 1 | 潮湿的空气 | 密封半浸入蒸馏水中 | 生锈多 |
| 2 | 除去二氧化碳的潮湿空气 | 密封半浸入蒸馏水中 | 生锈少 |
| 3 | 潮湿的空气 | 密封半浸入滴有少量稀盐酸的蒸馏水中 | 生锈最多 |
(7)除此之外,你还能从以上实验中得到的信息有(答一点即可):酸能更快促进铁生锈(合理均可).



