题目内容
10.金属是一种重要的资源,在日常生活中越来越得到广泛的应用.(1)铜常用于制作导线,因为其具有良好的导电性.
(2)将纯铝和铝合金相互刻划,纯铝上留有明显的痕迹,说明铝合金的硬度大于纯铝.
(3)如图,向一定量的硝酸银溶液中加入铜和锌的混合粉末,充分反应后过滤,得到溶液甲和固体乙.

①以下说法正确的是BCD(多选).
A.溶液甲一定有硝酸铜
B.溶液甲一定有硝酸锌
C.固体乙一定会有银析出
D.在溶液甲中滴加盐酸,若生成白色沉淀,则在固体乙中加入稀盐酸一定没有氢气产生
②若乙中含有铜、锌、银三种固体,则溶液甲中含有的金属离子是Zn2+(填离子符号),此时取固体乙加入稀硫酸,发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑该反应类型为置换反应.
分析 (1)根据铜的性质和用途分析.
(2)根据纯铝和铝的硬度分析回答.
(3)在金属活动性顺序中,排在前面的金属可以把位于它后面的金属从其盐溶液中置换出来,可简记为“前置后,盐可溶”.
解答 解:(1)铜常用于制作导线,因为其具有良好的导电性.
(2)将纯铝和铝合金相互刻画,纯铝上留下明显划痕,说明铝合金的硬度比纯铝的大.铝锅轻便、耐用的原因是铝的密度小,常温下,铝能够与氧气反应,从而在表面生成致密的氧化铝薄膜,阻止铝的进一步氧化.回收利用废旧金属的意义在于:可以减少环境污染,节约金属资源.
故填:减少环境污染,节约金属资源.
(3)在金属活动顺序表中,金属的活动性顺序是锌>铜>银.向一定量AgNO3溶液中加入铜和锌的混合粉末时,锌先与硝酸银反应,当锌反应完后,铜再与硝酸银反应.
①A.溶液甲不一定有硝酸铜,故A错误
B.溶液甲一定有硝酸锌,故B正确
C.固体乙一定会有银析出,故C正确
D.在溶液甲中滴加盐酸,若生成白色沉淀,说明了溶液中含有银,则在固体乙中加入稀盐酸一定没有氢气产生,故D正确.
②若乙中含有锌、铜、银三种固体,说明了溶液中没有硝酸银、硝酸铜,则溶液甲中所含的金属离子符号为:Zn2+,此时向固体乙中加入稀硫酸,锌能与发生反应,化学方程式为:Zn+H2SO4═ZnSO4+H2↑,该反应是一种单质与一种化合物反应生成了另一种单质和另一种化合物,属于置换反应.
故答为:(1)导电性;(2)铝合金的硬度比纯铝的大;(3)(4)①BCD,Zn2+,②Zn+2HCl═ZnCl2+H2↑,置换.
点评 本题主要考查物质的性质和用途,解答时应该理解物质的用途是由物质的哪种性质决定的;对于化学方程式的考查始终是中考的热点.

练习册系列答案
相关题目
5.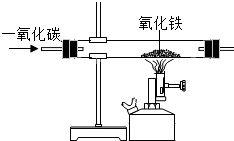 如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
 如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )| A. | 该实验的反应原理是FeO+CO$\frac{\underline{\;高温\;}}{\;}$ Fe+CO2 | |
| B. | 在实验过程中,黑色的粉末会逐渐变成红色 | |
| C. | 充分反应后,向固体中加稀盐酸会产生气泡 | |
| D. | 在实验过程中,产生的尾气可以直接排放到空气中 |
15.下列图象与所对应的实验相符的是( )
| A. |  向一定质量的稀盐酸中不断加水,溶液的pH变化情况 | |
| B. |  在密闭的硬质玻璃管中充满氢气,并盛有一定质量的氧化铜,加热反应时的氢气质 量变化情况 | |
| C. |  加热一定质量的氯酸钾和二氧化锰的混合物,二氧化锰在固体混合物中的质量分数 变化情况 | |
| D. |  在一定质量的稀盐酸与硫酸钠的混合溶液中逐渐滴加氯化钡溶液,沉淀的变化情况 |
2.比较推理是化学学习中常用的思维方法,下列推理正确的是( )
| A. | 镁条可在空气中燃烧,故铁丝也可在空气中燃烧 | |
| B. | 金刚石很硬,故石墨也很硬 | |
| C. | 二氧化碳可以灭火,一氧化碳也能灭火 | |
| D. | 生铁比纯铁硬,故黄铜比纯铜硬 |
19.植物的光合作用表示为水+二氧化碳$\stackrel{光照}{→}$淀粉+氧气,根基以上信息,关于淀粉的组成说法正确的是( )
| A. | 只有C、H元素 | B. | 含有C、H、O三种元素 | ||
| C. | 含有C、H元素,可能含有O元素 | D. | 缺少条件,无法确定 |
 汽泡爽是一种冲调饮料.其主要原料为柠檬酸(C6H8O7)和小苏打(NaHCO3);使用时将一包汽泡爽粉末倒入玻璃杯中,加入200mL冷水,看到有大量气泡快速生成,待粉末完全溶解,就得到一杯果味饮料.
汽泡爽是一种冲调饮料.其主要原料为柠檬酸(C6H8O7)和小苏打(NaHCO3);使用时将一包汽泡爽粉末倒入玻璃杯中,加入200mL冷水,看到有大量气泡快速生成,待粉末完全溶解,就得到一杯果味饮料.
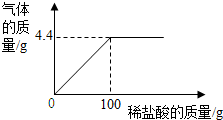 为测量Na2CO3和NaCl组成的样品中NaCl的质量分数,取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如图所示的曲线关系.(水的密度为1g/mL,质量分数计算结果精确到0.1%)
为测量Na2CO3和NaCl组成的样品中NaCl的质量分数,取15g该固体样品,全部溶于200mL水中,向所得到的混合溶液中逐滴滴入溶质质量分数为7.3%的稀盐酸,记录了如图所示的曲线关系.(水的密度为1g/mL,质量分数计算结果精确到0.1%)