题目内容
16.硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(氧化铁)等产品的部分流程如图所示:
(1)硫铁矿是混合物(填“纯净”或“混合”).
(2)写出C与Fe3O4反应的化学方程式Fe3O4+2C$\frac{\underline{\;高温\;}}{\;}$3Fe+2C02↑.
(3)酸浸、过滤后滤液中的溶质主要是FeSO4 (或H2SO4和FeSO4).
(4)反应Ⅰ的反应温度一般需控制在35℃以下,其目的是防止NH4HCO3分解(或减少Fe2+的水解).
(5)在空气中煅烧FeCO3生成Fe2O3与CO2,该反应的化学方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO.
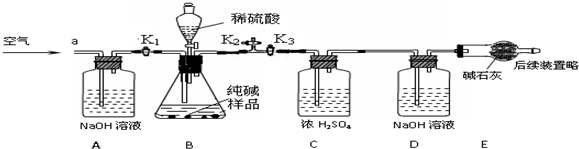
(6)产品a的主要成分是K2SO4,检验产品a中是否含有氯化物(Cl-)杂质的实验操作是:取少量产品a加水溶解,滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液.
分析 硫铁矿烧渣在灼烧时加入碳,发生氧化还原反应生成铁,加入硫酸后生成硫酸亚铁,过滤后得到的滤渣为二氧化硅,滤液中加入碳酸氢铵溶液,可生成碳酸亚铁固体,经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成铁红,反应Ⅰ过滤后所得溶液为硫酸铵和碳酸氢铵的混合物,加入硫酸得到硫酸铵,加入氯化钾可得到氯化铵和硫酸钾,以此解答该题.
解答 解:(1)由题意可知硫铁矿是由Fe2O3、Fe3O4、FeO、SiO2等成分组成的混合物;故答案:混合;
(2)C与Fe3O4在高温的条件下反应生成铁和二氧化碳,故答案为:Fe3O4+2C$\frac{\underline{\;高温\;}}{\;}$3Fe+2C02↑;
(3)焙烧后的固体为铁和二氧化硅的混合物,加入硫酸生成硫酸亚铁,如硫酸过量,则滤液中还含有硫酸,故答案为:FeSO4 (或H2SO4和FeSO4);
(4)为防止NH4HCO3分解(或减少Fe2+的水解),反应Ⅰ的反应温度一般需控制在35℃以下,故答案为:防止NH4HCO3分解(或减少Fe2+的水解);
(5)空气中煅烧FeCO3生成铁红,反应的方程式为4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2.
(6)产品a主要为硫酸钾,为检验是否含有氯化物杂质,应加入硝酸银,但在加入硝酸银之前应加入过量的硝酸钡溶液,以除去硫酸根离子,过滤后再加入硝酸银溶液,故答案为:滴加过量Ba(NO3)2溶液,过滤后向滤液中滴加AgNO3溶液.
点评 本题考查物质的制备,侧重于学生的分析能力和实验能力的考查,为高考常见题型和高频考点,注意把握实验的流程和制备原理,难度中等.

练习册系列答案
相关题目
10. 2014年5月7日,某公司在南京市进行探伤作业期间,丢失用于探伤的放射源铱-192一枚.据悉铱-192放射源会对人体造成损伤,严重的甚至死亡.元素周期表中“铱”的信息如图所示.下列关于铱元素说法正确的是( )
2014年5月7日,某公司在南京市进行探伤作业期间,丢失用于探伤的放射源铱-192一枚.据悉铱-192放射源会对人体造成损伤,严重的甚至死亡.元素周期表中“铱”的信息如图所示.下列关于铱元素说法正确的是( )
 2014年5月7日,某公司在南京市进行探伤作业期间,丢失用于探伤的放射源铱-192一枚.据悉铱-192放射源会对人体造成损伤,严重的甚至死亡.元素周期表中“铱”的信息如图所示.下列关于铱元素说法正确的是( )
2014年5月7日,某公司在南京市进行探伤作业期间,丢失用于探伤的放射源铱-192一枚.据悉铱-192放射源会对人体造成损伤,严重的甚至死亡.元素周期表中“铱”的信息如图所示.下列关于铱元素说法正确的是( )| A. | 是一种非金属元素 | B. | 铱原子核内质子数为77 | ||
| C. | 铱原子核内一定有77个中子 | D. | 铱的相对原子质量为192.2克 |
7.“塑化剂”是一种重要的工业原料,但被不法商家添加到食品中,造成了:“塑化剂风波”.已知“塑化剂”的化学式为C12H34O4,下列说法不正确的是( )
| A. | “塑化剂”的相对分子质量为242 | |
| B. | “塑化剂”是化合物 | |
| C. | “塑化剂”由碳、氢、氧三种元素组成 | |
| D. | “塑化剂”中碳、氢、氧元素的质量比为12:34:4 |
4.O2、N2、CO、CO2的混合气体依次通过灼热的铜网、澄清石灰水和灼热的氧化铜,充分反应后得到的气体是.( )
| A. | N2 | B. | N2、CO2 | C. | O2、CO2 | D. | CO、N2 |
1.某物质和CO2反应只生成Na2CO3和O2,则该物质中( )
| A. | 只含有氧元素 | B. | 一定含有钠元素和氧元素 | ||
| C. | 只含有钠元素 | D. | 一定含有钠元素,可能含有氧元素 |
8.为测定水样中氯离子含量,需2%的硝酸银溶液.若用硝酸银晶体配制100g该溶液,需加水( )
| A. | 48 g | B. | 49 g | C. | 98 g | D. | 99 g |
5.化学变化中一定有( )
| A. | 颜色变化 | B. | 其他物质生成 | C. | 沉淀析出 | D. | 气体放出 |