题目内容
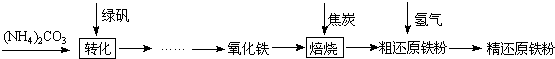
11.纯碱是重要的化工原料(一)制备探究:如图是工业生产纯碱的主要流程示意图.

【查阅资料】①粗盐水中含有杂质MgCl2、CaCl2;②常温下,NH3极易溶于水,CO2能溶于水,③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2、CaCl2的化学方程式:MgCl2+2NaOH=Mg(OH)2↓+2NaCl,CaCl2+Na2CO3=CaCO3↓+2NaCl.
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是有利于溶液吸收CO2气体,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl.
(3)“碳酸化”后过滤获得的NH4Cl可用作氮肥,也可先加热(填“加热”或“冷却”)NH4Cl溶液,再加入熟石灰获得循环使用的物质是NH3;
(4)煅烧制得纯碱的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(二)成分探究
【提出问题】纯碱样品中含有哪些杂质?
【猜想】猜想一:可能含有NaHCO3; 猜想二:可能含有NaCl;猜想三:NaHCO3和NaCl.
【实验探究】确定纯碱中是否含NaHCO3.实验装置和主要实验步骤如下:
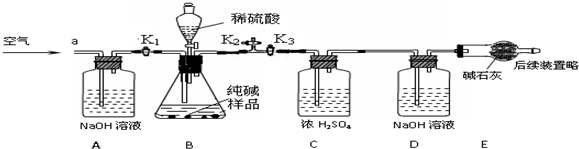
①称量D、E装置总质量为200.0g,将10.6 0g纯碱试样放入锥形瓶中,按上图组装后打开活塞K1和K2,关闭K3,缓缓鼓入一段时间空气;
②关闭活塞K1和K2,打开K3,加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D、E的总质量为204.84g.
【实验讨论】
(5)加入样品前还应检查装置气密性;
(6)装置A的作用是除去空气中的二氧化碳,装置C的作用是除去二氧化碳中的水;装置E的作用是吸收从D中带出的水;
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是将生成的二氧化碳全部送到D中,装置B中一定发生的化学反应方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑装置D中的化学反应方程式为CO2+2NaOH=Na2CO3+H2O.
(8)装置B中生成CO2的质量为4.84 g.通过计算说明纯碱中A含NaHCO3(填字母).
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知Na2CO3相对分子质量为106、NaHCO3相对分子质量为84):
(9)另取10.6样品,加入a g 14.6%的盐酸恰好完全反应,再将所得溶液蒸干后得到固体的质量为W,当W的值满足W>0.234a条件时,样品中含有NaCl.
分析 (1)根据除去粗盐水中MgCl2、CaCl2用的试剂是氢氧化钠溶液和碳酸钠溶液进行解答;
(2)根据在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是有利于溶液吸收CO2气体以及氯化钠、氨气、二氧化碳和水反应生成碳酸氢钠和氯化铵进行解答;
(3)根据“碳酸化”后过滤获得的NH4Cl含有氮元素、氯化铵不稳定受热易分解或遇到碱放出氨气进行解答;
(4)根据碳酸氢钠受热分解生成碳酸钠、水和二氧化碳进行解答;
【猜想三】根据纯碱样品中还可能含有NaHCO3和 NaCl进行解答;
(5)根据加入样品前还应检查装置气密性进行解答;
(6)根据空气中含有二氧化碳,装置A的作用是除去空气中的二氧化碳、浓硫酸和碱石灰具有吸水性进行解答;
(7)根据反应结束后打开止水夹K1,缓缓鼓入空气的目的是将生成的二氧化碳全部送到D中、碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳以及氢氧化钠溶液和二氧化碳反应生成碳酸钠和水进行解答;
(8)根据D、E增加的质量为二氧化碳的质量进行解答;
(9)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,假设全部是碳酸钠求出增加的质量进行解答.
解答 解:(1)除去粗盐水中MgCl2、CaCl2用的试剂是氢氧化钠溶液和碳酸钠溶液,反应的化学方程式分别为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、CaCl2+Na2CO3=CaCO3↓+2Na Cl;
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是有利于溶液吸收CO2气体;氯化钠、氨气、二氧化碳和水反应生成碳酸氢钠和氯化铵,反应的化学方程式为:NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)“碳酸化”后过滤获得的NH4Cl含有氮元素,所以可用作氮肥;氯化铵不稳定受热易分解或遇到碱放出氨气,也可先加热NH4Cl溶液,再加入熟石灰获得循环使用的物质是NH3(或氨气);
(4)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
【猜想三】纯碱样品中还可能含有NaHCO3和 NaCl的混合物;
(5)加入样品前还应检查装置气密性;
(6)空气中含有二氧化碳,装置A的作用是除去空气中的二氧化碳;浓硫酸和碱石灰具有吸水性,装置C的作用是除去二氧化碳中的水;装置E的作用是吸收从D中带出的水;
(7)反应结束后打开止水夹K1,缓缓鼓入空气的目的是将生成的二氧化碳全部送到D中;碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O;
(8)根据D、E增加的质量为二氧化碳的质量,装置B中生成CO2的质量=204.84g-200.0g=4.84g;
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
$\frac{106}{10.6g}$=$\frac{44}{x}$
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠;
(9)根据碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,假设全部是碳酸钠求出增加的质量.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
73 117
ag×14.6% W
$\frac{73}{ag×14.6%}$=$\frac{117}{W}$
W=0.234ag
所以当W的值满足条件W>0.234ag时,样品中含有NaCl;
故答案为:(1)MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CaCl2+Na2CO3=CaCO3↓+2Na Cl;
(2)有利于溶液吸收CO2气体;NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl;
(3)氮;加热;NH3(或氨气);
(4)2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
【猜想三】NaHCO3和 NaCl;
(5)检查装置气密性;
(6)除去空气中的二氧化碳; 除去二氧化碳中的水;吸收从D中带出的水;
(7)将生成的二氧化碳全部送到D中;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;CO2+2NaOH=Na2CO3+H2O;
(8)4.84; A;
假设10.6g样品全为碳酸钠,生成二氧化碳的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
10.6g x
$\frac{106}{10.6g}$=$\frac{44}{x}$
x=4.4g
4.4g<4.84g
所以样品中含有碳酸氢钠;
(9)W>0.234a
点评 此题考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 石墨(C) | B. | 干冰(CO2) | C. | 氯化钾(KCl) | D. | 苏打(Na2CO3) |
| A. | BaCl2 NaCl CaCl2 NaOH | B. | KNO3 NaCl AgNO3 Mg(NO3)2 | ||
| C. | CuSO4 KCl AgNO3 Na2SO4 | D. | BaCl2 CaCl2 KCl Al(NO3)3 |
| A. | 只有③④ | B. | 只有①⑤ | C. | 只有②⑤⑥ | D. | 全部 |