题目内容
14. 已知NaOH容易与空气中的CO2作用而变质.同学们在实验室发现一瓶敞口放置的NaOH固体后,设计方案,对这瓶NaOH固体的变质情况进行了如下实验探究.
已知NaOH容易与空气中的CO2作用而变质.同学们在实验室发现一瓶敞口放置的NaOH固体后,设计方案,对这瓶NaOH固体的变质情况进行了如下实验探究.【提出问题】:这瓶NaOH一定变质了,其变质程度如何呢?
【实验猜想】:甲同学的猜想:NaOH部分变质.你的新猜想:NaOH全部变质.
【实验探究】:甲同学设计如下实验来验证自己的猜想,请根据表中内容填写空格:
| 实验步骤 | 现象 | 结论 |
| ①取少量NaOH样品于试管中,加水溶解,滴加足量CaCl2溶液 | NaOH 部分变质 | |
| ②再滴加酚酞 |
(1)下列物质①BaCl2溶液、②Ca(NO3)2溶液、③Ca(OH)2溶液、④Ba(OH)2溶液,不能替代甲同学实验中CaCl2溶液的是③④ (填序号).
(2)若将②中加入的溶液换成某盐溶液,会产生与②中不同的实验现象,也可得出中相同的结论.写出一种符合条件的盐的化学式CuSO4或Fe2(SO4)3等.
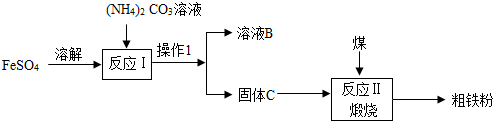
【探究拓展】为进一步确定原固体的组成,该实验小组的同学称取26.6g待检固体,加入150g稀盐酸恰好完全反应,产生气体质量与稀盐酸的关系如图所示,请计算:
(1)反应生成CO2的质量4.4g;
(2)固体混合物中Na2CO3的质量.
(3)所加稀盐酸的溶质质量分数.
分析 【实验猜想】根据氢氧化钠变质过程中可能出现的两种情况:要么全部变质要么部分变质的事实而提出猜想;
【实验探究】根据氢氧化钠变质程度结合碳酸钠能与氯化钙反应形成白色沉淀,可以判断出反应产生现象,然后利用氢氧化钠能使酚酞变红的性质,再向反应后溶液中滴加酚酞试液,观察溶液颜色,以确定溶液的组成;
【实验反思】(1)根据足量的CaCl2溶液可将碳酸钠全部反应掉,防止对氢氧化钠的检验产生干扰分析物质;
(2)根据氢氧化钠的性质分析选择合适的试剂;
【探究拓展】根据根据坐标读出生成CO2的质量计算出Na2CO3的质量,从而进一步确定样品中NaOH的质量、氯化氢的质量及稀盐酸的质量分数.
解答 解:【实验猜想】氢氧化钠吸收二氧化碳生成碳酸钠时,由于时间的关系,可能是部分变质,也可能是全部变质,因此,甲猜想部分变质,那么剩下的猜想就应该为全部变质;故填:NaOH全部变质;
【实验探究】氯化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氯化钠,所以根据题中的实验结论可以知道能观察到的现象为有白色沉淀生成,在反应后的溶液中滴入酚酞,而氢氧化钠溶液能使酚酞变红,所以根据结论氢氧化钠部分变质的实验现象可以知道溶液要变为红色;故填:生成白色沉淀;酚酞;溶液变红;
【实验反思】(1)足量的CaCl2溶液可将碳酸钠全部反应掉,防止对氢氧化钠的检验产生干扰,而氢氧化钙和氢氧化钡都能与碳酸钠反应产生氢氧化钠,因此不能确定氢氧化钠的存在;故填:③④;
(2)氢氧化钠可以与硫酸铜、硫酸铁等反应产生蓝色或红褐色的沉淀等,因此还可以选择CuSO4或Fe2(SO4)3等;故填CuSO4或Fe2(SO4)3等;
【拓展探究】(1)根据坐标可知反应生成CO2的质量为4.4g;
(2)设26.6g固体混合物中Na2CO3的质量为x,反应需要氯化氢的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 44
x y 4.4g
$\frac{106}{x}$=$\frac{44}{4.4g}$ x=10.6g
$\frac{73}{y}$=$\frac{44}{4.4g}$ y=7.3g
(3)26.6g混合物中含有氢氧化钠的质量为:26.6g-10.6g=16g
则16g氢氧化钠完全反应需要氯化氢的质量为a
NaOH+HCl=NaCl+H2O
40 36.5
16g a
$\frac{40}{16g}$=$\frac{36.5g}{a}$ a=14.6g
∴所用稀盐酸中溶质的质量分数=$\frac{7.3g+14.6}{150g}$×100%=14.6%
故答案为:4.4g;10.6g;14.6%.
点评 本题考查了氢氧化钠的变质的探究及有关的计算,这是氢氧化钠这一知识点的常考题型,具有典型的代表性,注意碳酸钠碱性对氢氧化钠的干扰的探究:先除去氢氧化钠中的碳酸钠,然后再证明剩余溶液显碱性,才能说明氢氧化钠部分变质.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A | B | C | D |
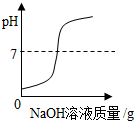 |  | 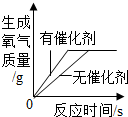 |  |
| 向一定量稀盐酸中加入过量氢氧化钠溶液 | 向一定量硫酸和硫酸铜混合溶液中加入过量的氢氧化钠溶液 | 用等质量、等溶质质量分数的双氧水分别制取氧气 | 向饱和澄清石灰水中加入固体CaO (恢复至原温度) |
| A. | A | B. | B | C. | C | D. | D |
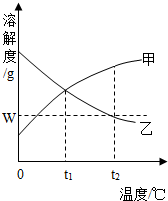 如图是甲、乙的溶解度曲线.在t2℃时向100g水中先后加入w g甲和乙(两种物质溶解时互不影响).充分搅拌.将混合物的温度降低到t1℃.下说法正确的是( )
如图是甲、乙的溶解度曲线.在t2℃时向100g水中先后加入w g甲和乙(两种物质溶解时互不影响).充分搅拌.将混合物的温度降低到t1℃.下说法正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | t2℃时,乙溶液溶质质量分数为w% | |
| C. | 温度降低到t1℃时,甲、乙的溶质质量分数相等 | |
| D. | t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液 |

| A. | 2CO+O2═2CO2 化合反应 | B. | 2HI+Cl2═2HCl+I2 置换反应 | ||
| C. | 2H2O═2H2↑+O2↑分解反应 | D. | 2HCl+CuO═CuCl2+H2O 复分解反应 |
| A. | 在铁制品表面刷漆可防止铁生锈,原理是隔绝了铁制品表面的氧气 | |
| B. | 使用pH试纸时,需要先用蒸馏水将其湿润 | |
| C. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢倒入水中,并不断搅拌 | |
| D. | 用红磷和白磷探究燃烧条件的实验结论是燃烧需要可燃物 |
 市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题:
市售的碳酸氢钠片是一种白色片状药剂,主要成份为碳酸氢钠(NaHCO3),用于缓解胃酸过多引起的胃痛、胃灼热感(烧心)、反酸等有关症状,根据题意,试回答以下问题: