题目内容
13.Fe(OH)3可用于制造医药、颜料等,其胶体可用于净水.某化学兴趣小组利用废铁屑来制备Fe(OH)3粉末的流程如下: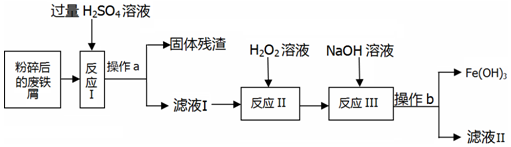
提示:①废铁屑主要为表面附有大量铁锈的铁.
②Fe(OH)3难溶于水,加热时会分解生成氧化铁和水.
③反应Ⅱ中加入H2O2溶液的目的是将滤液Ⅰ中的FeSO4氧化成Fe2(SO4)3.
(1)操作a的名称为过滤.
(2)反应Ⅰ中,需要49g 20%的H2SO4溶液与5.6g铁完全反应.
(3)反应Ⅱ中发生的化学方程式是2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2X,则X的化学式是H2O.
(4)反应Ⅲ中生成Fe(OH)3的化学方程式是6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4.
(5)操作b后得到的Fe(OH)3经洗涤后只能放在阴凉处晾干,而不能用酒精灯烘干,原因是Fe(OH)3加热时会分解成氧化铁和水.
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)操作a的结果是得到了滤液,从这个称呼可知该操作过滤.
(2)反应Ⅰ中,由于消耗了5.6g铁,设消耗的20%的稀硫酸溶液的质量为x
Fe+H2SO4=FeSO4+H2↑
56 98
5.6g 20%x
$\frac{56}{98}$=$\frac{5.6g}{20%x}$
x=49g
(3)反应Ⅱ中发生的化学方程式是2FeSO4+H2SO4+H2O2=Fe2(SO4)3+2X,根据质量守恒定律可得,反应前铁原子有2个,硫原子3个,氧原子16个,氢原子4个,反应后现有铁原子有2个,硫原子3个,氧原子12个,氢原子0个,缺少四个氢原子和两个氧原子,而这些原子分布在2个X分子中所以每个X分子是由两个氢原子和一个氧原子构成的,则X的化学式是 H2O.
(4)反应Ⅲ中生成Fe(OH)3的是硫酸铁和氢氧化钠反应生成氢氧化铁和硫酸钠,对应的化学方程式为 6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4.
(5)由于信息提示“Fe(OH)3难溶于水,加热时会分解生成氧化铁和水”,所以操作b后得到的Fe(OH)3经洗涤后只能放在阴凉处晾干,而不能用酒精灯烘干.
故答案为:
(1)过滤.
(2)49.
(3)H2O.
(4)6NaOH+Fe2(SO4)3=2Fe(OH)3↓+3Na2SO4.
(5)Fe(OH)3加热时会分解成氧化铁和水.
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题是什么,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

| A. | Na+--钠原子 | B. | 2Ca--两个钙元素 | C. | FeCl2--氯化铁 | D. | 3C--三个碳原子 |
| A. | 家中电器着火用水扑灭 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 浓硫酸不慎滴在皮肤上,用氢氧化钠溶液洗去 | |
| D. | 将化学实验产生的废液倒入废液缸,并进行妥善处理 |
| A. | 滤液中一定没有银离子 | B. | 滤渣中一定含有金属单质M | ||
| C. | 滤渣中一定含有单质铜 | D. | 加入的金属M可能是单质铁 |
| A. | H2-2个氢原子 | B. | 铁元素的化合价为+3-$\stackrel{+3}{Fe}$ | ||
| C. | 1个镁离子一Mg+2 | D. | 2N一2个氮元素 |

| A. | 液体肥皂 | B. | 西瓜汁 | C. | 酱油 | D. | 柠檬汁 |

 如图是用红磷测定空气中氧气含量的一种办法,请结合相关知识回答下列问题:
如图是用红磷测定空气中氧气含量的一种办法,请结合相关知识回答下列问题: