题目内容
18.回答下列问题:(1)用相应的化学符号填空:
①氮元素N; ②最简单的有机物CH4;
③三个硫酸根离子3SO42-; ④二氧化氯中氯元素的化合价$\stackrel{+4}{Cl}$O2.
(2)选择相应物质的字母填空:
A.熟石灰 B.石墨 C.纯碱 D.碳酸钙
①可作干电池电极的是B; ②可用作补钙剂的是D;
③用于中和土壤酸性的是A; ④厨房中用于洗涤油污中的“碱”是C.
(3)写出下列化学反应的化学方程式:
①铁在氧气中燃烧:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4; ②高锰酸钾受热分解:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
③绿色植物的光合作用:6CO2+6H2O$\frac{\underline{\;\;\;光能\;\;\;}}{叶绿体}$C6H12O6+6O2 ;
④二氧化氮和铜加热生成氧化铜和一种空气中的主要气体:2NO2+4Cu$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+N2.
分析 本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.
解答 解:(1)①氮元素的元素符号为:N;
②最简单的有机物是甲烷,其化学式为:CH4;
③离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故3个硫酸根离子可表示为:3SO42-;
④元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以二氧化氯中氯元素的化合价,故可表示为:$\stackrel{+4}{Cl}$O2;
(2)①可作干电池电极的是石墨;
②可用作补钙剂的是碳酸钙;
③用于中和土壤酸性的是熟石灰;
④厨房中用于洗涤油污中的“碱”是纯碱,即碳酸钠;
(3)①铁在氧气中燃烧燃烧,生成四氧化三铁,反应的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4;
②加热高锰酸钾能分解生成锰酸钾、二氧化锰和氧气,是一种物质生成三种物质的分解反应,故填:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
③绿色植物的光合作用反应的化学方程式为:6CO2+6H2O$\frac{\underline{\;\;\;光能\;\;\;}}{叶绿体}$C6H12O6+6O2;
④二氧化氮和铜加热生成氧化铜和一种空气中的主要气体,反应的化学方程式为:2NO2+4Cu$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+N2;
故答案为:(1)①N ②CH4 ③3SO42- ④$\stackrel{+4}{Cl}$O2(2)①B ②D ③A ④C
(3)①3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 ②2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;③6CO2+6H2O$\frac{\underline{\;\;\;光能\;\;\;}}{叶绿体}$C6H12O6+6O2 ④2NO2+4Cu$\frac{\underline{\;\;△\;\;}}{\;}$4CuO+N2
点评 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.

| A. | K+、SO42-、OH- | B. | Cl-、K+、CO32- | C. | K+、Cu2+、NO3- | D. | Ba2+、SO42-、K+ |
限选试剂:蒸馏水、稀盐酸、稀硫酸、稀硝酸、氢氧化钾溶液、氢氧化钠溶液、澄清石灰水、
硫酸钾溶液、硫酸钠溶液、碳酸钾溶液、碳酸钠溶液、
(1)要分离出硝酸钡溶液所需的试剂是碳酸钠和稀硝酸.
(2)请完成下列部分实验的实验报告
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该混合液于试管中 加入氢氧化钠溶液,振荡,过滤, 用蒸馏水洗涤滤渣; ②取洗涤后的滤渣加入稀硝酸. | 有白色沉淀生成,加入硝酸后,沉淀溶解 | 得到硝酸镁溶液 |
| A. | 用甲醛溶液浸泡海产品保鲜 | B. | 用食醋除去暖水瓶中的少量水垢 | ||
| C. | 用熟石灰改良酸性土壤 | D. | 可用氢氧化钠治疗胃酸过多症 |
【查阅资料】
Ⅰ白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水.
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2.
(1)同学们设计了以下实验装置:
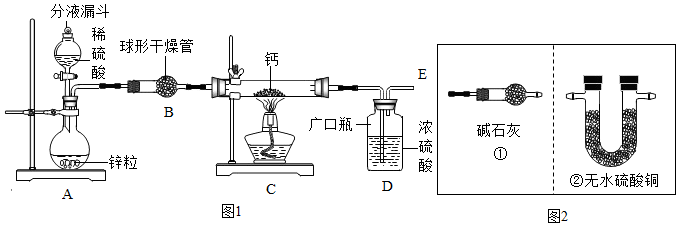
请回答:
①装置A中发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;为了实验安全,点燃C装置酒精灯前应先在E导管口收集氢气进行验纯或先通一会儿氢气;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的②(选填:①或②)装置;
③图1装置D中浓硫酸的作用是防止空气中的水蒸汽进入C中;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与CaH2,完成下表中内容.
| 实验步骤 | 预期现象和结论 |
| 取少量固体样品,在干燥条件下与氧气反应,将 其产物通入装有无水硫酸铜的干燥管; | 若观察到无水硫酸铜变蓝色,证明是氢化钙,反之是钙 |
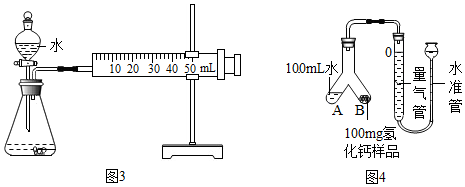
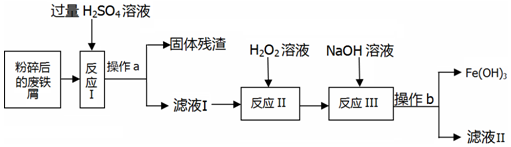
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在a时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是因液体加入引起气体排出(或反应放热气体温度升高,体积膨胀引起气体排出),导致气体体积测定变大;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL.将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL.已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的质量分数为66.3%;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便.既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是等质量的钙和CaH2与水完全反应,CaH2产生的氢气多.
 水和溶液在生产、生活中起着十分重要的作用.
水和溶液在生产、生活中起着十分重要的作用.