考点1.化学肥料的种类和作用
农作物生长需要多种营养元素,其中一部分来自空气、水和土壤,还有一部分靠化学肥料来补充。根据所含植物营养的不同,化肥可分为氮肥、磷肥、钾肥、复合肥料等。不同的化肥对农作物生长的作用是不同的(见表11-25-1)。
|
种类 |
主要作用 |
缺乏时的影响 |
|
氮肥 |
氮是植物体内蛋白质、核酸和叶绿素的组成元素 |
生长迟缓,植株叶片发黄 |
|
磷肥 |
促进作物生长,增强作物的抗寒、抗旱能力 |
缺磷时生长迟缓,产量下降 |
|
钾肥 |
钾具有增强抗病虫害和抗倒伏能力,保证各种代谢过程的顺利进行 |
茎秆细弱,容易倒伏 |
|
复合肥 |
能同时均匀地供给作物几种养分,充分发挥营养元素间的相互作用 |
|
考点2.化肥的鉴别, 的检验
的检验
不同的氮肥、磷肥、钾肥有不同的性质,根据化肥物理、化学性质不同可初步区分常见的化肥。如:氮肥、钾肥为白色晶体,磷肥为灰白色粉末状;含有 的氮肥加热或加NaOH可产生有刺激性气味的气体NH3。
的氮肥加热或加NaOH可产生有刺激性气味的气体NH3。
考点5.气体的干燥剂(实际应用考点)
浓硫酸、固体烧碱、碱石灰、无水氯化钙可用作气体干燥剂,由于它们的性质不同,被干燥的气体也不同。一般规律见表10-22-3:
表10-22-3
|
干燥剂 |
可干燥的气体 |
不能干燥的气体 |
|
|
酸性 |
浓H2SO4 |
H2、O2、CO、CO2、HCl、CH4、N2、SO2 |
NH3 |
|
中性 |
无水氯化钙 |
除NH3外的其他气体 |
NH3 |
|
碱性 |
固体NaOH、碱石灰、生石灰 |
H2、O2、N2、CO、CH、CH4、NH3 |
CO2、SO2、HCl等 |
第23讲 酸碱之间会发生的反应
考点1.酸碱指示剂
(1)定义:跟酸或碱溶液作用显示不同颜色的物质,叫酸碱指示剂,通常也简称指示剂。
(2)常用的指示剂:石蕊和酚酞是两种常用的指示剂,它们与酸溶液,碱溶液作用时显示的颜色见表10-22-1:
表10-22-1
 溶液 溶液试液 |
酸溶液 |
碱溶液 |
|
紫色石蕊试液 |
变红色 |
变蓝色 |
|
无色酚酞试液 |
不变色 |
变红色 |
考点2.浓盐酸、浓硫酸的物理性质及浓硫酸的特性和稀释方法
(1)浓盐酸、浓硫酸的物理性质见表10-22-2。
表10-22-2
|
|
颜色、状态 |
气味 |
挥发性 |
|
浓盐酸 |
无色液体 |
刺激性气味 |
易挥发 |
|
浓硫酸 |
无色黏稠液体 |
无味 |
不挥发 |
(2)浓硫酸的特性:①脱水性:能够夺取纸张、木材、布料、皮肤里的水,使它们脱水生成黑色的炭,发生炭化。②吸水性:浓硫酸跟空气接触,能够吸收空气里的水分,可用作某些气体的干燥剂。③强烈的腐蚀性。④强氧化性,与金属反应时一般不生成氢气。
(3)浓硫酸的稀释:稀释浓硫酸时,一定要将浓硫酸沿着器壁慢慢地注入水里,并不断搅拌,使产生的热量迅速地扩散,切不可把水倒入浓硫酸中。
考点3.酸的性质及用途
(1)常见的酸:在生活中和实验中常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)等。
(2)盐酸的性质及用途:①化学性质:a.与酸碱指示剂作用;b.与活泼金属发生置换反应;c.与金属氧化物(碱性氧化物)反应;d.与碱发生中和反应;e.与AgNO3发生复分解反应。②用途:重要化工产品,用于金属表面除锈,制造药物等,人体胃液中含有盐酸,可帮助消化。
(3)硫酸的性质及用途:①化学性质:a.与酸碱指示剂作用;b.与活泼金属发生置换反应;c.与金属氧化物(碱性氧化物)反应;d.与碱发生中和反应;e与BaCl2发生复分解反应。②用途:重要化工原料,用于生产化肥、农药、火药、染料以及冶炼金属和金属除锈等。
考点4.碱的性质及用途
(1)常见的碱:氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氨水(NH3·H2O)等。
(2)氢氧化钠的性质及用途:①物理性质:氢氧化钠是一种白色固体,极易溶于水,并放出大量的热,容易吸收空气中的水而潮解。②俗名:烧碱、火碱、苛性钠。③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。④用途:化工原料,应用于肥皂、石油、造纸、纺织和印染工业,生活中可用于去油污,固体可用作干燥剂。
(3)氢氧化钙的性质及用途:①物理性质:氢氧化钙是一种白色粉末状固体,微溶于水,水溶液俗称石灰水。②俗名:熟石灰、消石灰。③化学性质:a与酸碱指示剂作用;b与非金属氧化物反应;c与酸发生中和反应;d与某些盐发生复分解反应。④用途:用于建筑业,制取氢氧化钠,漂白粉,农业上改良酸性土壤,配制农药波尔多液和石硫合剂。
 ,OH-与Cu2+、Fe3+,
,OH-与Cu2+、Fe3+,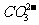 与Ca2+、Ba2+等不能大量共存;②生成气体:如OH-与
与Ca2+、Ba2+等不能大量共存;②生成气体:如OH-与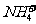 ,H+与
,H+与 等不能共存;③生成H2O:如H+与OH-不能共存。另外还应注意题中的附加条件,如溶液无色透明,则溶液中肯定没有有色离子(常见的有色离子如Fe3+、Cu2+、Fe2+、
等不能共存;③生成H2O:如H+与OH-不能共存。另外还应注意题中的附加条件,如溶液无色透明,则溶液中肯定没有有色离子(常见的有色离子如Fe3+、Cu2+、Fe2+、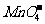 等);pH=1为强酸性溶液;pH=14为强碱性溶液。
等);pH=1为强酸性溶液;pH=14为强碱性溶液。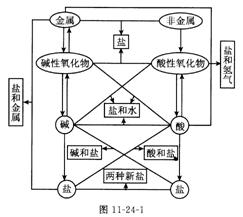
 的检验方法
的检验方法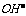 结合生成水的过程,
结合生成水的过程,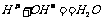 。
。 (1)溶液的酸碱度是指溶液的酸性强弱程度。
(1)溶液的酸碱度是指溶液的酸性强弱程度。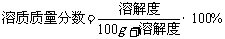 。
。 。
。