摘要:考点1.中和反应及其应用 (1)定义:酸与碱作用生成盐和水的反应.叫中和反应.如NaOH+HCl == NaCl+H2O. (2)中和反应的实质:酸溶液中的H+与碱溶液中的结合生成水的过程.. (3)中和反应与复分解反应的关系:中和反应是复分解反应的一种.复分解反应包括中和反应.即中和反应一定是复分解反应.但复分解反应不一定都是中和反应. (4)酸碱中和实验要用指示剂:酸与碱反应生成盐和水.如果只从外观上看.无明显现象.由于酸碱指示剂在酸性.碱性和中性溶液中各显示不同的颜色.因此根据颜色变化可判断中和反应的终点. (5)中和反应的应用:中和反应在日常生活和工农业生产中有广泛的应用.如:改良酸性土壤.处理废水.用于医药等. 考点2.溶液酸碱度的表示方法--pH (1)溶液的酸碱度是指溶液的酸性强弱程度. (2)表示方法:用pH来表示.pH的范围通常在0~14之间.PH=7时.溶液呈现中性.pH<7时.溶液呈中性.pH<7时.溶液呈酸性,pH>7时.溶液呈现碱性. (3)pH的测定方法:测定溶液的酸碱度通常用pH试纸粗略测量.测定方法:①在玻璃片或白瓷板上放一片pH试纸.②用玻璃棒蘸取待测液滴在pH试纸上.③将试纸显示的颜色与标准比色卡比较便知溶液的pH.
网址:http://m.1010jiajiao.com/timu_id_4410475[举报]
(2013?曲靖)归纳是化学学习的重要方法之一,在以下的归纳中你认为是正确或者是错误的,都请你按要求举例证明.
(1)中和反应生成盐和水,但生成盐和水的反应不一定是中和反应.(用化学方程式说明)
(2)分解反应就是一种物质生成两种物质的反应.(用化学方程式说明)
(3)合金都是由金属元素组成的.(用实例说明)
(4)盐溶液一定显中性.(用实例说明)
查看习题详情和答案>>
(1)中和反应生成盐和水,但生成盐和水的反应不一定是中和反应.(用化学方程式说明)
对,CO2+2NaOH═Na2CO3+H2O
对,CO2+2NaOH═Na2CO3+H2O
.(2)分解反应就是一种物质生成两种物质的反应.(用化学方程式说明)
错,2KMnO4
K2MnO4+MnO2+O2 ↑
| ||
错,2KMnO4
K2MnO4+MnO2+O2 ↑
.
| ||
(3)合金都是由金属元素组成的.(用实例说明)
错,生铁和钢中含有C
错,生铁和钢中含有C
.(4)盐溶液一定显中性.(用实例说明)
错,Na2CO3溶液显碱性
错,Na2CO3溶液显碱性
.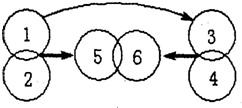 20、有H2SO4、Ba(OH)2、Mg、Na2SO4.四种物质,分别用圆圈代表其中一种物质,相交的圆圈表示能发生化学反应,且反应生成6时有白色沉淀,箭头指向的圆圈表示生成物(有生成物已略去),“→”表示能转化成该物质,试回答:
20、有H2SO4、Ba(OH)2、Mg、Na2SO4.四种物质,分别用圆圈代表其中一种物质,相交的圆圈表示能发生化学反应,且反应生成6时有白色沉淀,箭头指向的圆圈表示生成物(有生成物已略去),“→”表示能转化成该物质,试回答:(1)1和2反应的基本类型是
置换
反应;(2)5和6反应的现象是
有白色沉淀生成
(3)若1通过中和反应转化成3,写出该反应的化学方程式
H2SO4+2NaOH═Na2SO4+2H2O
.
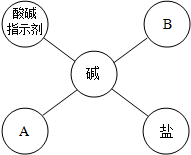 (2012?福建)如图是碱与不同类别物质间反应的关系图.
(2012?福建)如图是碱与不同类别物质间反应的关系图.