考点1.原子的构成
 (1)原子结构。
(1)原子结构。
②不同种类的原子,核内的质子数不同,核外的电子数也不同。③在原子中,核电荷数=质子数=核外电子数。原子核内的质子数不一定等于中子数,由于原子核所带电量和核外电子所带电量相等,且电性相反,因此,整个原子呈电中性。④并不是所有原子的原子核都是由质子和中子两种微粒构成的,在所有原子中,普通氢原子的原子核内只有质子,没有中子。
(2)相对原子质量:①相对原子质量的定义:以碳12(含有6个质子和6个中子的碳原子)原子质量的 作为标准,其他原子的质量与它相比较所得的比,就是该种原子的相对原子质量。②计算公式:相对原子质量的符号为Ar,相对原子质量(Ar)=
作为标准,其他原子的质量与它相比较所得的比,就是该种原子的相对原子质量。②计算公式:相对原子质量的符号为Ar,相对原子质量(Ar)= ;相对原子质量≈质子数+中子数。③注意问题:a.相对原子质量是个比值,单位为“1”(通常省略不写),它不表示原子的实际质量。b.由于质子和中子的质量近似相等,都约为一个电子质量的1836倍,故电子的质量可以忽略不计,原子的质量主要集中在原子核上。c.原子的实际质量与相对原子质量成正比。④相对原子质量与原子的质量的比较(见表4-10-1):
;相对原子质量≈质子数+中子数。③注意问题:a.相对原子质量是个比值,单位为“1”(通常省略不写),它不表示原子的实际质量。b.由于质子和中子的质量近似相等,都约为一个电子质量的1836倍,故电子的质量可以忽略不计,原子的质量主要集中在原子核上。c.原子的实际质量与相对原子质量成正比。④相对原子质量与原子的质量的比较(见表4-10-1):
表4-10-1
|
|
原子质量 |
相对原子质量 |
|
来源 |
测定出来的 |
比较出来的 |
|
性质 |
绝对的 |
相对的 |
|
数值 |
非常小 |
≥1,大多数为整数 |
|
单位 |
kg |
单位是1 |
|
以碳12为例 |
1.993×10-26kg |
12 |
|
联系 |
相对原子质量=原子的质量÷一个碳12原子质量的1/12(原子的质量越大,其相对原子质量也越大) |
考点2.元素与元素符号
(1)元素:①定义:具有相同核电荷数(即核内质子数)的一类原子的总称。②性质:a. 元素是个宏观概念,它只能组成物质而不能构成分子或原子;b. 元素只讲种类不讲个数;c. 化学变化中,元素的种类和质量保持不变。③分类:元素可分为金属元素、非金属元素和稀有气体元素三大类。④含量:a. 在地壳中,氧元素最多,其次为硅、铝、铁等元素;b. 在空气中,氮元素最多,其次是氧元素;c. 在生物体中,氧元素最多,其次是碳元素和氢元素。⑤决定:质子数决定了元素的种类,不同元素的区别是因为它们的质子数不相同。
(2)元素与原子的区别(见表4-10-2);
表4-10-2
|
项 目 |
元 素 |
原 子 |
|
|
定义 |
具有相同核电荷数(即核内质子数)的一类原子的总称 |
化学变化中的最小粒子 |
|
|
区别 |
含义 |
宏观概念,只表示种类不表示个数 |
微观概念,既表示种类又表示个数 |
|
使用范围 |
表示物质的宏观组成。如水是由氢元素和氧元素组成的 |
表示物质的微观构成。如1个水分子是由2个氢原子和1个氧原子构成的 |
|
|
联系 |
具有相同核电荷数(即质子数)的一类原子总称为元素 |
 (3)物质、元素、分子、原子之间的关系(见图4-10-1);
(3)物质、元素、分子、原子之间的关系(见图4-10-1);
(4)元素符号:①写法:用拉丁文名称的第一个字母的大写来表示,如果第一个字母相同,还必须附加一个小写字母以示区别(110号元素以后除外)。②意义:宏观意义:表示一种元素;由原子直接构成的物质,其组成元素符号还表示这种物质。微观意义:表示该元素的一个原子。例如,“H”宏观意义表示氢元素,微观意义表示一个氢原子。③元素符号周围数字的意义:元素符号前面的数字表示原子个数,例如“2H”表示两个氢原子:元素符号右下角的数字表示一个分子中原子的个数,例如“H2O”中的数字表示一个水分子中含有两个氢原子。
考点3.核外电子的排布情况
 (1)核外电子排布:①电子层:电子在原子核外一定的区域内运动,这些区域称为电子层,核外电子是分层排布的。核外电子的分层排布是因为电子的能量各不相同,能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动。②核外电子排布的规律:第一层最多可容纳2个电子,第二导最多可容纳8个电子,最外层最多可容纳8个电子(最外层为第一层时,只能容纳2个电子)。核外电子总是从最内层开始依次向外排布。核外电子的排布规律很多,在高中阶段再继续学习。
(1)核外电子排布:①电子层:电子在原子核外一定的区域内运动,这些区域称为电子层,核外电子是分层排布的。核外电子的分层排布是因为电子的能量各不相同,能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动。②核外电子排布的规律:第一层最多可容纳2个电子,第二导最多可容纳8个电子,最外层最多可容纳8个电子(最外层为第一层时,只能容纳2个电子)。核外电子总是从最内层开始依次向外排布。核外电子的排布规律很多,在高中阶段再继续学习。
(2)原子结构示意图:①原子结构示意图各部分表示的意义(如图4-10-3所示)。②元素的性质与原子结构的关系。元素的性质元素的原子核外电子排布有密切的关系,特别是元素的化学性质跟它的原子的最外层电子数目关系更加密切。③分析1~18号元素的分类及原子结构示意图,得表4-10-3所示结论:
表4-10-3
|
元素分类 |
最外层电子数 |
结构的稳定性 |
化学性质 |
|
金属元素 |
一般<4(较少) |
不稳定 |
易失去最外层电子 |
|
非金属元素 |
一般≥(较多) |
不稳定 |
易得到电子 |
|
稀有气体元素 |
8(He为2个) |
稳定 |
难得失电子,一般参加化学反应 |
考点1.分子
(1)分子的概念:分子是保持物质化学性质的最小粒子。
(2)分子的基本性质:①分子的质量和体积都很小。1个水分子质量约为3×10-26kg;1滴水(以20滴水为1mL计)中大约有1.67×1021个水分子,分子是肉眼看不见的微观粒子。②分子在不断地运动。分子总是在不断运动着,蔗糖在水中的扩散,湿衣服晾干等都是分子运动的结果。分子的运动与温度有关,温度高时分子运动得快,温度低时分子运动得慢。③分子间有间隔。物质的三态变化就是因为分子间的间隔不同的缘故,物体的热胀冷缩现象就是物质分子间的间隔受热时增大,遇冷时缩小的缘故。④同种分子,化学性质相同;不同种分子,化学性质不相同。⑤分子可以构成物质。
考点2.原子
(1)原子的概念:原子是化学变化中的最小粒子。
(2)原子的基本性质:①原子的体积和质量都很小。②原子是不停地运动的,且运动与温度有关,温度高时运动得快,温度低时运动得慢。③原子间也有间隔。④原子可以直接构成物质。
(3)原子与分子的区别和联系(见表3-9-1)。
表3-9-1
|
|
分 子 |
原 子 |
|
概念 |
保持物质化学性质的最小粒子 |
化学变化中的最小粒子 |
|
相似点 |
质量与体积都很小;在不停地运动;相互之间有一定的间隔;同种物质的分子化学性质相同,不同种物质的分子化学性质不同;同种原子性质相同,不同种原子性质不同 |
|
|
不同点 |
化学反应中可以分成原子,原子重新组合成新的分子 |
在化学变化中不能再分 |
|
互相联系 |
分子由原子构成 |
原子可以构成分子,原子也可以直接构成物质 |
 。④化合物中某元素的质量=化合物的质量×该元素的质量分数。
。④化合物中某元素的质量=化合物的质量×该元素的质量分数。


 );②书写顺序:先写正负,后写数值;③化合价与离子表示方法的异同点。相同点:化合价和离子电荷的正负与数值相同。
);②书写顺序:先写正负,后写数值;③化合价与离子表示方法的异同点。相同点:化合价和离子电荷的正负与数值相同。 (3)常见元素的化合价。熟记常见元素的化合价,钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧为负二价;铜汞正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四六。
(3)常见元素的化合价。熟记常见元素的化合价,钾钠氢银正一价,钙镁锌钡正二价;氟氯溴碘负一价,通常氧为负二价;铜汞正二铝正三,铁有正二和正三;碳有正二和正四,硫有负二正四六。 =原子个数;检查。②根据化学式确定元素或根的化合价。
=原子个数;检查。②根据化学式确定元素或根的化合价。
 (1)离子的概念:带电的原子(或原子团)叫做离子。带正电的叫阳离子(或正离子),带负电的叫阴离子(或负离子)。
(1)离子的概念:带电的原子(或原子团)叫做离子。带正电的叫阳离子(或正离子),带负电的叫阴离子(或负离子)。
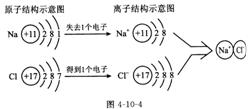 ②符号的意义:3Mg2+表示3个镁离子
②符号的意义:3Mg2+表示3个镁离子 考点6.物质的构成与组成及分类的有关知识(学科内综合考点)
考点6.物质的构成与组成及分类的有关知识(学科内综合考点)
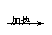 日常生活中常见的一些现象,可从物理变化和化学变化中分子、原子的变化方面去分析。物质在发生物理变化时,分子本身没有变化,只是分子之间的距离与分子间位置发生变化而已。如水
日常生活中常见的一些现象,可从物理变化和化学变化中分子、原子的变化方面去分析。物质在发生物理变化时,分子本身没有变化,只是分子之间的距离与分子间位置发生变化而已。如水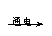 水蒸气,水分子本身没有发生变化,只是水分子间的间隔变大了,其化学性质也没有变化。物质在发生化学变化时,分子发生了本质的变化,变成了其他物质的分子,如水
氢气+氧气。新的分子的形成是原子重新组合的结果,因此化学变化中分子破裂成原子,原子重新组合成新的物质的分子。根据以上分析的原理可以从微观角度解释物质的变化现象。
水蒸气,水分子本身没有发生变化,只是水分子间的间隔变大了,其化学性质也没有变化。物质在发生化学变化时,分子发生了本质的变化,变成了其他物质的分子,如水
氢气+氧气。新的分子的形成是原子重新组合的结果,因此化学变化中分子破裂成原子,原子重新组合成新的物质的分子。根据以上分析的原理可以从微观角度解释物质的变化现象。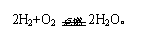 (2)氢气的化学性质。①可燃性: 纯净的氢气在空气(或氧气)中安静燃烧,火焰呈淡蓝色;而不纯的氢气(空气中混入氢气的体积达到体积总量的4.0%~74.2%)遇明火发生爆炸,因此点燃氢气前必须要验纯。检验氢气纯度的方法:用排水法收集一试管氢气,用拇指堵住管口,使管口始终向下,移近火焰,移开拇指点火,如果听到尖锐的爆鸣声,就表明氢气不纯,需再检验,直到响声很小,证明已纯。如果用向下排空气法收集氢气,经检验不纯而需再检验时,应用拇指堵住试管口一会儿,再收集氢气检验。②还原性:
实验装置特点:a.试管口略向下倾斜(防止水倒流炸裂试管);b.导管伸到试管底部(尽快全部排出空气,使H2与CUO充分接触);c.试管口不加橡皮塞(便于试管中气体导出,防止加热时发生爆炸)。实验操作步骤:实验开始时,先通入经过验纯的氢气,然后加热(否则易发生爆炸)。实验结束时应先撤酒精灯,继续通氢气至试管冷却为止(否则会使生成的铜重新被氧化成氧化铜)。可简记为:先通氢,后点灯;先撤灯,后停氢。实验现象:黑色氧化铜逐渐变成红色,试管口出现小水滴。
(2)氢气的化学性质。①可燃性: 纯净的氢气在空气(或氧气)中安静燃烧,火焰呈淡蓝色;而不纯的氢气(空气中混入氢气的体积达到体积总量的4.0%~74.2%)遇明火发生爆炸,因此点燃氢气前必须要验纯。检验氢气纯度的方法:用排水法收集一试管氢气,用拇指堵住管口,使管口始终向下,移近火焰,移开拇指点火,如果听到尖锐的爆鸣声,就表明氢气不纯,需再检验,直到响声很小,证明已纯。如果用向下排空气法收集氢气,经检验不纯而需再检验时,应用拇指堵住试管口一会儿,再收集氢气检验。②还原性:
实验装置特点:a.试管口略向下倾斜(防止水倒流炸裂试管);b.导管伸到试管底部(尽快全部排出空气,使H2与CUO充分接触);c.试管口不加橡皮塞(便于试管中气体导出,防止加热时发生爆炸)。实验操作步骤:实验开始时,先通入经过验纯的氢气,然后加热(否则易发生爆炸)。实验结束时应先撤酒精灯,继续通氢气至试管冷却为止(否则会使生成的铜重新被氧化成氧化铜)。可简记为:先通氢,后点灯;先撤灯,后停氢。实验现象:黑色氧化铜逐渐变成红色,试管口出现小水滴。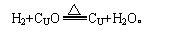 (3)氢气的用途。①充灌探空气球;②冶炼金属;③作高能燃烧;④作化工原料。
(3)氢气的用途。①充灌探空气球;②冶炼金属;③作高能燃烧;④作化工原料。