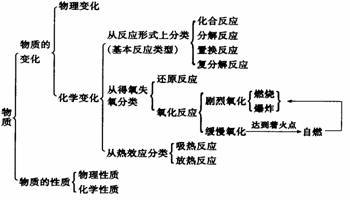
4.化学反应类型
(1)基本反应类型
表1-3 基本反应类型
|
|
概念 |
简单表达式 |
举例 |
||
|
化合反应 |
两种或两种以上的物质 生成一种物质的反应 |
A+B=AB |
2Mg + O2  2MgO 2MgOCaO + H2O == Ca(OH)2 |
||
|
分解反应 |
一种物质生成两种或两 种以上其他物质的反应 |
AB=A+B |
CaCO3  CaO + CO2 ↑ CaO + CO2 ↑
 2H2 ↑+ O2
↑ 2H2 ↑+ O2
↑
|
||
|
置换反应 |
一种单质跟一种化合物 反应,生成另一种单质 和另一种化合物的反应 |
A+BC= B+AC |
H2SO4(稀)+ Zn═ ZnSO4 + H2↑ Fe + CuSO4 ═ FeSO4 + Cu |
||
|
复分解 反应 |
有两种化合物相互交换 成分,生成另外两种化 合物的反应 |
AB+CD= AD+CB |
HCl + NaOH == NaCl + H2O H2SO4+ CuO == CuSO4 + H2O |
在这四种基本反应类型中,置换反应和复分解反应较为复杂。
表1-4 置换反应的类型及发生的条件
 表1-5 复分解反应的类型及发生的条件
表1-5 复分解反应的类型及发生的条件
 (2)氧化反应和还原反应
(2)氧化反应和还原反应
从化学反应中反应物得氧或失氧的角度,可以把相应的化学反应分为氧化反应和还原反应。
①氧化反应:物质跟氧发生的化学反应叫做氧化反应。
②还原反应:含氧化合物里的氧被夺去的反应,叫做还原反应。
③氧化剂:供给氧,使别的物质发生氧化反应的物质。
④还原剂:夺取氧,使含氧化合物发生还原反应的物质。
例如:
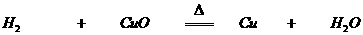
得氧 失氧
氧化反应 还原反应
被氧化 被还原
还原剂 氧化剂
一种物质被氧化,同时另一种物质被还原的反应叫做氧化还原反应。
注意:
a.反应中的“得氧”、“失氧”指的都是氧元素。
b.氧化反应和还原反应一定同时发生,在反应中有一种物质被氧化,必有另一种物质被还原。
c.氧化剂和还原剂都存在于反应物中。
⑤氧化反应与化合反应的区别:
化合反应从反应物与生成物种类上看,是“多变一”,而氧化反应则是反应物跟氧发生的反应。因此氧化反应不一定是化合反应,化合反应也不一定是氧化反应,它们之间没有必然联系。
如CH4+2O2 2H2O+CO2是氧化反应,但不属于化合反应;CaO + H2O == Ca(OH)2是化合反应,但不是氧化反应。
2H2O+CO2是氧化反应,但不属于化合反应;CaO + H2O == Ca(OH)2是化合反应,但不是氧化反应。
(3)吸热反应、放热反应
①吸热反应:指吸收热量的反应。
例如:C + CO2  2 CO
2 CO
②放热反应:指放出热量的反应。
例如:碳在氧气中燃烧放出大量的热。-
2.物理性质、化学性质
表1-2 物理性质与化学性质的比较
|
|
物理性质 |
化学性质 |
|
概念 |
物质不需要发生化学变化就能表现 出来的性质 |
物质在化学变化中表现出来的性质 |
|
实质 |
物质的分子组成结构不变,没有改 变所呈现的性质 |
物质的分子组成结构改变,所呈现的 性质也随之改变 |
|
性质 内容 |
颜色、状态、气味、熔点、沸点、 硬度、密度、溶解性、导电性、 导热性等 |
一般指物质与H2、O2、金属、非金属、 氧化物、酸、碱、盐等能否发生反应及 热稳定性 |
1.物理变化、化学变化
表1-1 物理变化与化学变化的区别和联系
|
|
物理变化 |
化学变化 |
|
概念 |
没有新物质生成的变化 |
变化时生成了新物质的变化 |
|
本质区别 |
宏观:没有新物质生成 微观:若是由分子构成物质, 分子不发生变化,只是分子间 的间隔、分子运动速度的大小 变了 |
宏观:有新物质生成 微观:分于本身发生了变化, 变成了新分子 |
|
外观特征 |
物质的状态、形状等发生了变化 |
常伴随发光、放热、变色、放出 气体、生成沉淀等 |
|
举例 |
水的三态变化、汽油挥发 |
镁条燃烧、碱式碳酸铜受热分解 |
|
区分依据 |
有没有新的物质生成 |
|
|
联系 |
在物理变化中,一般不会发生化学变化,但在化学变化中,一定同时 发生物理变化。 |
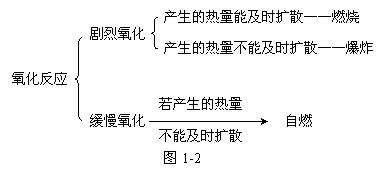 它们的本质特征:都是氧化反应,只是反应进行的剧烈程度不同。它们之间的关系如下:
它们的本质特征:都是氧化反应,只是反应进行的剧烈程度不同。它们之间的关系如下: