3.离子化合物和共价化合物 化合价
(1)离子化合物
①定义:由阴、阳离子相互作用而构成的化合物,就是离子化合物。如氯化钾、氯化镁、碳酸钠、氢氧化钠等。
②离子化合物的形成:在一定条件下,活泼的金属与活泼的非金属相互作用时,金属元素的原子失去最外层电子转变成阳离子,非金属元素的原子得到电子转变成阴离子。然后,阴阳离子相互作用就形成离子化合物。
典型金属(如钾、钠、钙等)与典型非金属(如氟、氯、氧等)或酸根、氢氧根常形成离子化合物。
③组成元素:一般由金属元素与非金属元素组成。但有例外,如(NH4)2SO4、NH4Cl等铵盐。
④离子化合物表示式--化学式。
(2)共价化合物
①定义:以共用电子对形成分子的化合物叫共价化合物。如水、二氧化碳等。
②共用电子对:两种元素的原子相互作用的结果是双方各以最外层1个电子组成一个电子对,这个电子对为两个原子所共用,在两个原子核外的空间运动,从而使双方最外层都达到稳定结构。这种电子对,叫共用电子对。
③共价化合物的形成:一定条件下,两种不同的非金属元素的原子相遇时,由于它们都不易失去电子,而获得电子的难易程度又相差不大,所以都不能把对方的电子夺取过来,即没有发生电子的得、失,而是双方都提供电子组成共用电子对,使双方最外层都达到稳定结构,共用电子对受两个核的共同吸引,从而使相互作用的两个原子形成共价化合物分子。
④组成元素:一般由不同种非金属元素组成。
⑤共价化合物表示式--化学式(也叫分子式)。
(3)化合价
①定义:一种元素一定数目的原子跟其他元素一定数目的原子相化合的性质,叫做这种元素的化合价。
②元素化合价的数值和正负的确定。
表2-5 元素化合价数值和正负确定比较表
|
|
化合价的数值 |
正价 |
负价 |
|
离子化合物 |
一个原子得失电子的数目 |
失去电子的原子为 正价 |
得到电子的原子为 负价 |
|
共价化合物 |
一个原子的共用电子对 的数目 |
电子对偏离的原子 为正价 |
电子对偏向的原子 为负价 |
③元素化合价符号:
化合价用+1、+2、-1、-2、-3……表示,将其标在元素符号的正上方。
④化合价原则:在化合物里,正负化合价的代数和为零。
⑤化合价一般规律:
A.在化合物里,氧通常显-2价,氢通常显+1价。
B.在化合物里,金属元素通常显正价,非金属元素通常显负价,但在非金属氧化物里,氧元素显负价,另一种非金属元素显正价。
C.单质中元素化合价为零。
D.某些元素具有可变化合价。由于同一种元素的原子在不同的条件下,失去电子(或提供电子)的个数不同,所以表现出不同的化合价。如NH4NO3中,氮元素分别呈-3价和+5价。
E.原子团也表现出一定的化合价,原子团中各元素化合价的代数和等于根价。
例如:在硫酸根离子SO42-里,硫元素的化合价为+6,氧元素的化合价是-2,代数和为:+6+(-2)×4=-2。
○技巧方法

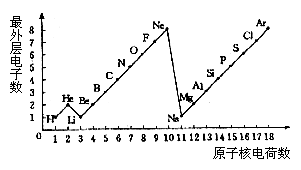
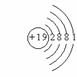 [辨析]此题要求学生归纳1-18号元素的排列规律,旨在考查学生对所给信息的观察、比较、分析能力及逻辑推理能力。解题时,应从各原子结构示意图的核电荷数、电子层数、最外层电子数等方面进行分析,找出纵、横行的排列规律,然后根据该规律,进行推理,得出结论。
[辨析]此题要求学生归纳1-18号元素的排列规律,旨在考查学生对所给信息的观察、比较、分析能力及逻辑推理能力。解题时,应从各原子结构示意图的核电荷数、电子层数、最外层电子数等方面进行分析,找出纵、横行的排列规律,然后根据该规律,进行推理,得出结论。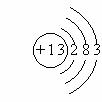 ,下列关于该元素的说法错误的是( )(2003年重庆市中考题)
,下列关于该元素的说法错误的是( )(2003年重庆市中考题)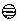 ”表示氢原子,用“
”表示氢原子,用“ ”表示氧原子,则保持水的化学性质的最小粒子可表示为( )(2004年福建福州中考题)
”表示氧原子,则保持水的化学性质的最小粒子可表示为( )(2004年福建福州中考题)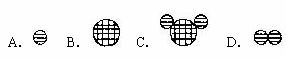


 表示氧原子,
表示氧原子, 表示氢原子。根据此图,试分别从物质组成、分子构成、物质变化的角度各说出一种观点:
表示氢原子。根据此图,试分别从物质组成、分子构成、物质变化的角度各说出一种观点: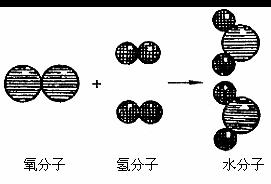
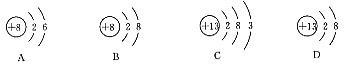
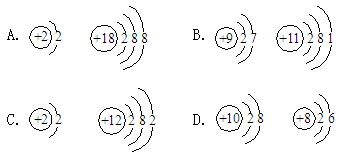
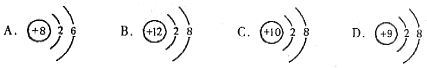
 [例16]纳米技术的研究是当前世界科技研究的一个热点,1998年中国科学家合成了纳米氮化镓。已知镓(Ca)原子结构示意图如下所示,则氮化镓的化学式最可能是( )(2003年杭州中考题)
[例16]纳米技术的研究是当前世界科技研究的一个热点,1998年中国科学家合成了纳米氮化镓。已知镓(Ca)原子结构示意图如下所示,则氮化镓的化学式最可能是( )(2003年杭州中考题)