摘要:化学反应类型 (1)基本反应类型 表1-3 基本反应类型 概念 简单表达式 举例 化合反应 两种或两种以上的物质 生成一种物质的反应 A+B=AB 2Mg + O2 2MgO CaO + H2O == Ca(OH)2 分解反应 一种物质生成两种或两 种以上其他物质的反应 AB=A+B CaCO3 CaO + CO2 ↑ 通电 2H2O 2H2 ↑+ O2 ↑ 置换反应 一种单质跟一种化合物 反应.生成另一种单质 和另一种化合物的反应 A+BC= B+AC H2SO4(稀)+ Zn═ ZnSO4 + H2↑ Fe + CuSO4 ═ FeSO4 + Cu 复分解 反应 有两种化合物相互交换 成分.生成另外两种化 合物的反应 AB+CD= AD+CB HCl + NaOH == NaCl + H2O H2SO4+ CuO == CuSO4 + H2O 在这四种基本反应类型中.置换反应和复分解反应较为复杂. 表1-4 置换反应的类型及发生的条件 表1-5 复分解反应的类型及发生的条件 (2)氧化反应和还原反应 从化学反应中反应物得氧或失氧的角度.可以把相应的化学反应分为氧化反应和还原反应. ①氧化反应:物质跟氧发生的化学反应叫做氧化反应. ②还原反应:含氧化合物里的氧被夺去的反应.叫做还原反应. ③氧化剂:供给氧.使别的物质发生氧化反应的物质. ④还原剂:夺取氧.使含氧化合物发生还原反应的物质. 例如: 得氧 失氧 氧化反应 还原反应 被氧化 被还原 还原剂 氧化剂 一种物质被氧化.同时另一种物质被还原的反应叫做氧化还原反应. 注意: a.反应中的“得氧 .“失氧 指的都是氧元素. b.氧化反应和还原反应一定同时发生.在反应中有一种物质被氧化.必有另一种物质被还原. c.氧化剂和还原剂都存在于反应物中. ⑤氧化反应与化合反应的区别: 化合反应从反应物与生成物种类上看.是“多变一 .而氧化反应则是反应物跟氧发生的反应.因此氧化反应不一定是化合反应.化合反应也不一定是氧化反应.它们之间没有必然联系. 如CH4+2O22H2O+CO2是氧化反应.但不属于化合反应,CaO + H2O == Ca(OH)2是化合反应.但不是氧化反应. (3)吸热反应.放热反应 ①吸热反应:指吸收热量的反应. 例如:C + CO2 2 CO ②放热反应:指放出热量的反应. 例如:碳在氧气中燃烧放出大量的热.-
网址:http://m.1010jiajiao.com/timu3_id_90117[举报]
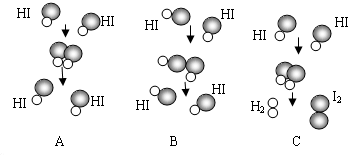
某化学反应可用如图所示来表示,请根据图示回答:

(1)该反应的基本反应类型属于
(2)该反应生成的物质属于
(3)分析以上漫画图示,你还能总结出的一条结论是
查看习题详情和答案>>

(1)该反应的基本反应类型属于
化合
化合
反应.?(2)该反应生成的物质属于
化合物或氧化物
化合物或氧化物
.(填物质分类)?(3)分析以上漫画图示,你还能总结出的一条结论是
参加反应的各物质质量总和等于反应后生成的各物质质量总和(答案合理即可)
参加反应的各物质质量总和等于反应后生成的各物质质量总和(答案合理即可)
.