2.原子结构
(1)原子的结构
①原子的构成:原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。原子核是由质子和中子两种粒子构成的。

每一个原子内只有一个原子核,它体积小,位于原子中心,集中了原子的全部正电荷,也几乎集中了原子的全部质量。电子质量很小,所带电量数与质子数相等,电性相反,故原子呈中性。
②原子的相对原子质量:国际上一致同意以一种碳原子的质量的1/12(约1.66×
10-27kg)作为标准,其他原子的质量跟它比较所得的值,就是这种原子的相对原子质量。相对原子质量是一种比值,它的单位是一,符号为“1”(一般不写出)。由于电子的质量仅相当于质子或中子质量的1/1836,故原子的质量主要集中在原子核上。以此推出,相对原子质量近似等于中子数与质子数之和。
相对原子质量的计算方法是:
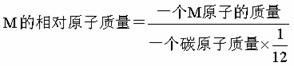
“一种碳原子”指原子核内有6个质子和6个中子的碳原子(称碳12)。
表2-4 构成原子的粒子及其性质比较表
|
类别 |
质子 |
中子 |
电子 |
|
电性 |
带正电 |
不带电 |
带负电 |
|
电量 |
1 |
0 |
1 |
|
相对质量 |
≈1 |
≈1 |
≈1/1836 |
|
对元素 的作用 |
质子数决定 元素的种类 |
中子数影响元素 的相对原子质量 |
最外层电子数决定元素的化学性质 |
③原子结构中的几个等量关系:
A.质子数=核电荷数=核外电子数。
B.相对原子质量≈质子数+中子数。原子质量主要集中在原子核上。
C.原子核内质子数不一定等于中子数,普通氢原子的原子核内无中子。
④原子核外电子排布的初步知识:
含有多个电子的原子,其核外电子可以看作是在能量不同的电子层上运动,并有一定规律。
电子层:通常用电子层来形象表明运动着的电子离核远近的不同,由里向外依次叫一、二、三、四、五、六、七层,也可依次称为K、L、M、N、O、P、Q层,其电子层能量由里向外依次增强。
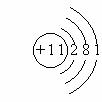
⑤原子、离子的结构示意图:
|
例如:原子结构示意图(Na) 离子结构示意图(Na+)
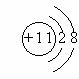
(2)原子结构与元素性质的关系
①稳定结构与不稳定结构:
稳定结构:像稀有气体元素的原子最外电子层上有8个电子(除He)的结构称为稳定结构。
不稳定结构:原子最外电子层上没有达到像稀有气体元素的原子那样的结构。
②元素种类与原子最外电子层上电子数的关系:
稀有气体元素:最外层电子数=8(He是2)。
金属元素:最外层电子数<4。
非金属元素:最外层电子数≥4(H、He、B除外)。
③元素的性质与原子最外层电子数的关系:
A.质子数是元素一切特征的最基本因素,它决定元素种类。
B.元素的化学性质主要取决于原子结构中的最外层电子数。最外层电子数越少,则越易失去电子,元素的金属性越活泼;最外层电子数越多,则越易得电子,元素的非金属性越活泼;反之亦然。稀有气体元素的原子最外层上达到了8个电子(He为2个电子)的稳定结构,一般化学性质稳定。
C.最外电子层上的电子数,决定元素的最高正化合价和负化合价,元素的最高正化合价=最外层电子数;负化合价=8-最外层电子数。
④质子数与核外电子总数大小比较:
原子:质子数=核外电子总数
阳离子:质子数>核外电子总数
阴离子:质子数<核外电子总数
⑤中子数只影响原子的相对质量
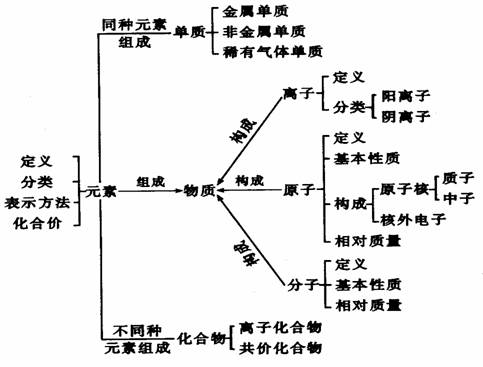
1.物质的组成与构成
(1)物质的宏观组成
从宏观上讲,物质(纯净物)是由元素组成的。
①元素定义:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。
定义中的注意点:元素是核电荷数相同的原子的总称,只能论种类,不能讲个数。如:水是由氢元素和氧元素组成的,不能说成“水是由两个氢元素和一个氧元素组成的”。元素是同一类原子的总称,这里说的“同一类原子”所指的可以是其核电荷数相同而存在状态或化合价不同的同类而不同种的原子,如N2、NO、HNO3、NH3中的氮原子,总称为氮元素。“同一类原子”所指也可以是其核电荷数相同而核外电子数不同的原子与简单离子,如Fe、Fe2+、Fe3+总称为铁元素。“同一类原子”所指的还可以是核电荷数相同而核内中子数并不一定相同的原子,如C-12、C-13、C-14,其核内质子数均为6而核内中子数分别为6、7、8,它们是三种不同的原子,但属于同一类原子,即都是碳原子,总称为碳元素。
②元素划分种类的依据:核电荷数(核内质子数)是划分元素种类的依据。质子数相同的原子和它的离子都属于同一种元素,但质子数相同的粒子不一定属于同一种元素。如Ne和H2O质子数相同,但不是同种元素。
③元素存在状态:游离态和化合态。游离态存在于单质中,化合态存在于化合物中。如O2中氧元素是处于游离态,H2O中氧元素处于化合态。
④元素的分类:元素可分为金属元素、非金属元素、稀有气体元素。如K、Na、Ca属于金属元素,Cl、F、O属于非金属元素,Ar、Ne等为稀有气体元素。
⑤元素的表示方法:元素用元素符号来表示。如镁:Mg。
(2)物质的微观构成
构成物质的粒子有分子、原子和离子。
①分子
A.定义:分子是保持物质化学性质的最小粒子。
定义理解应注意的关键点:
“化学性质”,而不是物理性质或其他性质。因为对于由分子构成的物质来说,其物理性质是由大量分子的聚积体所体现的,单个的分子表现不出物质的颜色、气味、状态、密度等,也就是说分子不保持物质的物理性质。
“最小粒子”,这是针对由分子构成的物质而言的。原子构成分子,分子保持着物质的化学性质。如二氧化碳是由二氧化碳分子构成,二氧化碳分子又是由碳原子和氧原子构成的,但保持二氧化碳化学性质的最小粒子是二氧化碳分子。
B.分子的基本性质:
a.体积和质量都很小。
b.分子是不断运动的。如:蒸发、溶解等。
c.分子间有间隔。如:物质在不同条件下“三态”变化。
d.同种分子性质相同,不同种分子性质不同。
②原子
A.定义:原子是化学变化中的最小粒子。
对定义的理解与认识:
在化学变化中,反应物分子分解成更小的粒子--原子,原子再重新组合成新物质(即生成物)的分子,这就是化学变化的实质。在化学变化前、后,原子的种类没有改变(主要是原子核没有改变),数目没有增减,原子在化学变化中不能再分裂成更小的粒子,所以说原子是化学变化中的最小位子。
原子在化学变化中不可分,但并不等于说原子不可分。科学实验证明,原子可分为原子核和核外电子,原子核可分为质子和中子。
B.原子的基本性质:
a.原子的体积和质量都很小。
b.原子是不断运动的。
c.原子间有间隔。
d.同种原子性质相同,不同种原子性质不同。
③原子团
定义:在许多化学反应里,作为一个整体参加反应,好像一个原子一样。这样的原于集团叫做原子团。
常见原子团:硝酸根(NO3-)、氢氧根(OH-)、硫酸根(SO42-)、铵根(NH4+)、碳酸根(CO32-)、磷酸根(PO43-)等。
注:原子团并不是在任何反应中都保持不变。如:2KClO3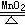 2KCl +3O2↑
2KCl +3O2↑
④离子
A.定义:带电的原子或原子团叫离子。
B.分类:阴离子和阳离子。
阴离子:带负电荷的原子或原子团,如Cl-、OH-。
阳离子:带正电荷的原子或原子团,如Na+、NH4+。
(3)几组概念的区别和联系
表2-1 元素与原子比较表
|
|
元素 |
原子 |
|
区别 |
①用于宏观,表示物质由哪些元素 组成 ②只讲种类,不论个数,没有数量 多少的含义 |
①用于微观,表示物质的分子由哪些 及几个原子构成 ②既讲种类,又讲个数,有数量多少 的含义 |
|
适用 范围 |
描述物质的宏观组成。如水是由氢、氧两种元素组成的 |
描述物质的微观结构。如一个水分子是由两个氢原子和一个氧原子构成的 |
|
联系 |
只要核电荷数相同附的一类原子就是同一种元素,原子是元素的最小单位, 而元素则是原子的一个“集体”。 |
表2-2 原子与离子比较表
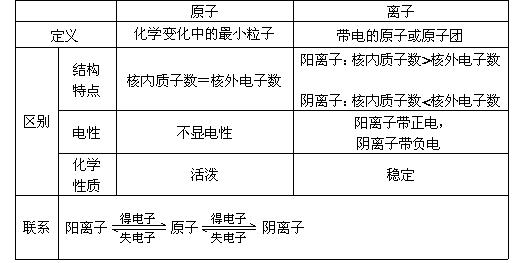
表2-3 分子和原子的比较表
|
|
分子 |
原子 |
|
区别 |
①保持物质化学性质的最小粒子 ②在化学变化中,分子可以再分 ③构成共价化合物和某些单质 |
①化学变化中的最小粒子 ②在化学反应中,不能再分 ③构成分子,也直接构成某些单质 |
|
联系 |
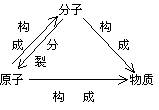 |