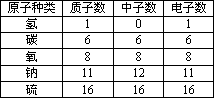
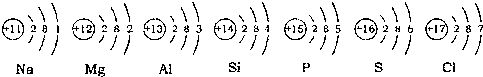摘要:原子结构 (1)原子的结构 ①原子的构成:原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的.原子核是由质子和中子两种粒子构成的. 每一个原子内只有一个原子核.它体积小.位于原子中心.集中了原子的全部正电荷.也几乎集中了原子的全部质量.电子质量很小.所带电量数与质子数相等.电性相反.故原子呈中性. ②原子的相对原子质量:国际上一致同意以一种碳原子的质量的1/12(约1.66× 10-27kg)作为标准.其他原子的质量跟它比较所得的值.就是这种原子的相对原子质量.相对原子质量是一种比值.它的单位是一.符号为“1 .由于电子的质量仅相当于质子或中子质量的1/1836.故原子的质量主要集中在原子核上.以此推出.相对原子质量近似等于中子数与质子数之和. 相对原子质量的计算方法是: “一种碳原子 指原子核内有6个质子和6个中子的碳原子. 表2-4 构成原子的粒子及其性质比较表 类别 质子 中子 电子 电性 带正电 不带电 带负电 电量 1 0 1 相对质量 ≈1 ≈1 ≈1/1836 对元素 的作用 质子数决定 元素的种类 中子数影响元素 的相对原子质量 最外层电子数决定元素的化学性质 ③原子结构中的几个等量关系: A.质子数=核电荷数=核外电子数. B.相对原子质量≈质子数+中子数.原子质量主要集中在原子核上. C.原子核内质子数不一定等于中子数.普通氢原子的原子核内无中子. ④原子核外电子排布的初步知识: 含有多个电子的原子.其核外电子可以看作是在能量不同的电子层上运动.并有一定规律. 电子层:通常用电子层来形象表明运动着的电子离核远近的不同.由里向外依次叫一.二.三.四.五.六.七层.也可依次称为K.L.M.N.O.P.Q层.其电子层能量由里向外依次增强. ⑤原子.离子的结构示意图: 图2-2 例如:原子结构示意图(Na) 离子结构示意图(Na+) (2)原子结构与元素性质的关系 ①稳定结构与不稳定结构: 稳定结构:像稀有气体元素的原子最外电子层上有8个电子的结构称为稳定结构. 不稳定结构:原子最外电子层上没有达到像稀有气体元素的原子那样的结构. ②元素种类与原子最外电子层上电子数的关系: 稀有气体元素:最外层电子数=8. 金属元素:最外层电子数<4. 非金属元素:最外层电子数≥4. ③元素的性质与原子最外层电子数的关系: A.质子数是元素一切特征的最基本因素.它决定元素种类. B.元素的化学性质主要取决于原子结构中的最外层电子数.最外层电子数越少.则越易失去电子.元素的金属性越活泼,最外层电子数越多.则越易得电子.元素的非金属性越活泼,反之亦然.稀有气体元素的原子最外层上达到了8个电子的稳定结构.一般化学性质稳定. C.最外电子层上的电子数.决定元素的最高正化合价和负化合价.元素的最高正化合价=最外层电子数,负化合价=8-最外层电子数. ④质子数与核外电子总数大小比较: 原子:质子数=核外电子总数 阳离子:质子数>核外电子总数 阴离子:质子数<核外电子总数 ⑤中子数只影响原子的相对质量
网址:http://m.1010jiajiao.com/timu3_id_90080[举报]
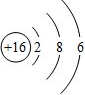 硫原子的结构示意图如右图所示.请根据图示和下列要求填写化学符号:
硫原子的结构示意图如右图所示.请根据图示和下列要求填写化学符号:(1)硫原子的符号:
(2)化合物中硫元素最常见的化合价:
(3)硫原子与氧原子组成的硫酸根离子:
(4)硫、钠两种元素组成的化合物:
原子序数11-17元素的符号和原子结构示意图如图1,请结合下图回答:
(1)结合图用1符号表示下列内容:
①原子序数为13的原子形成的离子符号
②原子序数为12、17的元素组成化合物的化学式
(2)从11-17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:
(3)根据如图2粒子的结构示意图回答问题
①一共表示
②达到稳定结构的是
查看习题详情和答案>>

(1)结合图用1符号表示下列内容:
①原子序数为13的原子形成的离子符号
Al3+
Al3+
,②原子序数为12、17的元素组成化合物的化学式
MgCl2
MgCl2
.(2)从11-17,随着原子序数的增加,其原子结构(或元素的性质)呈现出的变化规律是:
随着原子序数的增加,最外层电子数依次递增
随着原子序数的增加,最外层电子数依次递增
.(任写一条)(3)根据如图2粒子的结构示意图回答问题
①一共表示
6
6
种元素,属于非金属元素的是(1)(2)(4)(5)
(1)(2)(4)(5)
(填序号).②达到稳定结构的是
(2)(3)(6)
(2)(3)(6)
(填序号)