摘要:对原子的构成.原子核外电子排布的初步知识的掌握.
网址:http://m.1010jiajiao.com/timu3_id_90076[举报]
(4分)下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:
(1)写出硫元素的一种氧化物的化学式 。
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3)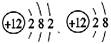 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。
下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:
(1)从原子结构上分析,图中氧、硫元素具有相似化学性质的主要原因是 ;
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3) 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。
(4分)下表是元素周期表中的1~18号元素原子核外电子排布,我们对它进行研究:

(1)写出硫元素的一种氧化物的化学式 。
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3) 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。
(4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。

(1)写出硫元素的一种氧化物的化学式 。
(2)写出质子数为1、6、8、11四种元素组成的可以治疗胃酸过多物质的化学式: 。
(3)
 表示一种元素的两种粒子,它们属于同一种元素的依据是 。
表示一种元素的两种粒子,它们属于同一种元素的依据是 。 (4)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因 。
24、下表是元素周期表中1~18号元素原子核外电子排布,我对它进行研究:

(1)原子序数为16的元素名称
(2)通过对元素周期表的分析,我能得出的一条信息是
(3)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强.由此推断:第二周期中得电子能力最强的的是
查看习题详情和答案>>

(1)原子序数为16的元素名称
硫元素
是非金属元素
,在化学反应中,该元素的原子容易得
(填“得”或“失”)电子,成为阴
(填“阴”或“阳”)离子,离子符号为S2-
,原子序数为13的元素属于金属
(填“金属”或“非金属”).(2)通过对元素周期表的分析,我能得出的一条信息是
从左到右,元素原子的原子序数依次增加
.(3)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强.由此推断:第二周期中得电子能力最强的的是
F
原子,具有稳定结构的是Ne
原子.试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题:
 氢(H) 氢(H) |  氦(He) 氦(He) | ||||||
 锂(Li) 锂(Li) |  铍(Be) 铍(Be) |  硼(B) 硼(B) | 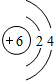 碳(C) 碳(C) |  氮(N) 氮(N) |  氧(O) 氧(O) |  氟(F) 氟(F) |  氖(Ne) 氖(Ne) |
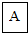 钠(Na) | 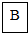 镁(Mg) |  铝(Al) |  硅(Si) 硅(Si) |  磷(P) 磷(P) |  硫(S) 硫(S) | 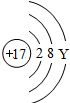 氯(Cl) 氯(Cl) |  氩(Ar) 氩(Ar) |
①从原子结构示意图分析,11~18号元素排在一行的依据是______;
②在此周期中,从左到右,原子结构变化情况是______;
③在此周期中,从左到右,元素原子得失电子的变化情况是______;
④在此周期中,从左到右,元素种类的变化情况是______.
(2)上图中硫元素的核电荷数Z=______;氯元素的最外层电子数Y=______(填数值).
(3)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______.
它的核外电子排布与______元素的原子核外电子排布相同.
(4)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加.你还能找到哪些规律?试写出其中一个:______.
(5)钙元素是人体中的常量元素,它在人体内99%存在于骨骼和牙齿中.该元素的原子结构示意图如图
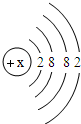 所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.该元素在上表中位于______(选A、B、C)处.
所示,则该元素的原子序数为______,该元素属于______(填“金属”或“非金属”)元素,该元素在化合物中的常见化合价为______.该元素在上表中位于______(选A、B、C)处.(6)月球上的3He(3表示相对原子质量)蕴藏量巨大,探月的目标之一是探测核聚变燃料3He的分布.地球上的氦元素主要以4He形式存在.从原子的构成来看,3He、4He两种原子的电子数______(填相同或不同),化学性质______. 查看习题详情和答案>>