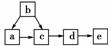
13.(12分)氨气的喷泉实验基本操作步骤可分为以下几步:
A.使倒置烧瓶下端的玻璃管插入盛有水的烧杯里(水中事先加入酚酞试液)
B.取带有喷嘴和止水夹的长玻璃管、吸满水的胶头滴管,先后插入双孔橡皮塞
C.挤压滴管的胶头,使少量的水进入烧瓶
D.取一根带尖嘴的玻璃管,玻璃管的另一端用橡胶管与另一玻璃管相连,并用止水夹夹住橡胶管
E.在干燥的圆底烧瓶中充满氨气
F.将圆底烧瓶用铁夹固定在铁架台上
G.将止水夹移到下端玻璃管上
H.用带有玻璃管和胶头滴管的塞子塞紧瓶口
(1)正确的操作步骤是(填字母):_____→_____→_______→H→A→_______G→_______。
(2)喷泉实验前如何证明圆底烧瓶中几乎充满了氨气?
________________________________________________________________________
________________________________________________________________________。
(3)喷泉的颜色可因为烧杯中的液体或圆底烧瓶中气体的改变而不同,试填写下表以实现喷泉的颜色变化:
|
烧瓶中的气体 |
烧杯中的液体 |
烧杯中液体的颜色 |
喷泉的颜色 |
|
NH3 |
水+酚酞 |
无色 |
红色 |
|
|
|
红色 |
无色 |
|
|
|
蓝色 |
紫色 |
|
|
|
无色 |
蓝色 |
(4)标准状况下,用排气法收集CO2气体到250 mL烧瓶中,烧杯中盛有0.25 mol/L的NaOH溶液,喷泉实验完成后,进入烧瓶的溶液体积为烧瓶容积的4/5。试判断此时烧瓶中溶液的溶质可能是____________(不考虑由胶头滴管挤入烧瓶中引发实验所用的NaOH溶液)。
根据你的判断,从以下两空选答其中一空:
若溶质只有一种,请计算其物质的量浓度________;
若溶质不止一种,请写出它们的物质的量浓度之比________。
[答案] (1)D→B→E→H→A→F→G→C(或E→D→B→H→A→F→G→C)
(2)将烧瓶倒立,用蘸有浓HCl的玻璃棒靠近瓶口,若有白烟产生,证明氨气已充满(或者用湿润的红色石蕊试纸靠近瓶口看是否变蓝)
(3)
|
烧瓶中的气体 |
烧杯中的液体 |
烧杯中液体的颜色 |
喷泉的颜色 |
|
NH3 |
水+酚酞 |
无色 |
红色 |
|
HCl |
NaOH溶液+酚酞 |
红色 |
无色 |
|
SO2(CO2) |
NaOH溶液+石蕊 |
蓝色 |
紫色 |
|
NO2+O2 |
KI-淀粉试液 |
无色 |
蓝色 |
(4)NaOH和Na2CO3 c(NaOH)∶c(Na2CO3)=18∶5
10.用下图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
( )
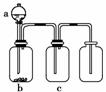
|
|
气体 |
a |
b |
c |
|
A |
NO2 |
浓硝酸 |
铜片 |
NaOH溶液 |
|
B |
SO2 |
浓硫酸 |
Cu |
酸性KMnO4溶液 |
|
C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
|
D |
CO2 |
稀盐酸 |
CaCO3 |
浓硫酸 |
[解析] 因NaOH溶液可以吸收NO2气体,A项错误;因酸性KMnO4溶液可以吸收SO2,且制备时需有加热装置,B项错误;因收集NH3时应用向下排空气法,C项错误。
[答案] D

 2MgO;②3Mg+N2
2MgO;②3Mg+N2
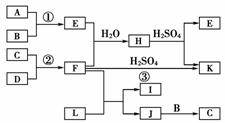
 ,K”,且“K是常用的氮肥”可推出F为NH3,则C、D为N2、H2;再结合“JC”和“J由两种元素组成,其相对分子质量为32”,可推出C只能为N2,J为N2H4;又根据“L具有漂白性;可由Cl2与NaOH溶液反应而制得”可推出L为NaClO。
,K”,且“K是常用的氮肥”可推出F为NH3,则C、D为N2、H2;再结合“JC”和“J由两种元素组成,其相对分子质量为32”,可推出C只能为N2,J为N2H4;又根据“L具有漂白性;可由Cl2与NaOH溶液反应而制得”可推出L为NaClO。