31.(8分)[化学--化学与技术]
工业上以磷肥生产形成的副产物石膏(CaSO4·2H2O)与焦炭为原料可生产硫酸,同时
可以得到硫酸钾肥料和氯化钙水合物储热材料。以下是有关的工艺流程示意图。
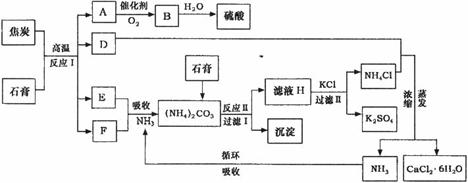
试回答:
(1)写出反应Ⅰ、反应Ⅱ的化学方程式
反应Ⅰ___________________________________,
反应Ⅱ______________________________________。
(2)请根据下表和化学平衡知识,分析工业上制硫酸中SO2的催化氧化的适宜条件是
____________________________________。
表Ⅰ:
 压 强 / M Pa
压 强 / M Pa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(3)检验滤液H中含有CO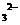 的方法是___________________________________。
的方法是___________________________________。
(4)氯化钙结晶水合物(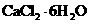 )是目前常用的无机储热材料,选择的依据是___________(填序号)。
)是目前常用的无机储热材料,选择的依据是___________(填序号)。
a.熔点较低(29℃熔化) b.能导电 c.易溶于水 d.无毒
29.(12分)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
(1)该工艺的中间过程会发生反应: ,反应的氧化剂是_____________________。
,反应的氧化剂是_____________________。
(2)尾气中的SO2经处理可得到有价值的化学品,写出其中1种酸和1种盐的名称
____________________________。
(3)黄铜矿熔炼后得到的粗铜含少量Fe、Zn、Ag、Au等金属杂质,需进一步采用电解法精制。在精炼铜时,阳极材料是________,阴极电极反应式是_____________________。
(4)在精炼铜的过程中,电解液中 逐渐下降,
逐渐下降,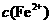 、
、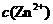 会逐渐增人,所以需定时除去其中的
会逐渐增人,所以需定时除去其中的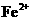 、
、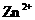 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
|
物质 |
 |
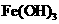 |
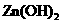 |
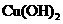 |
溶度积 |
 |
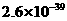 |
 |
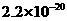 |
甲同学设计了如下除杂方案:
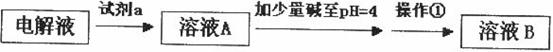
试剂a是__________,其目的是____________________________________;根据溶度积该方
案能够除去的杂质金属阳离子是____________。
乙同学在查阅资料时发现,“工业原料氯化铵中含杂质氯化铁,使其溶入水,再加入氨水
调节pH至7-8,可使 生成
生成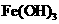 。沉淀而除去。”乙同学认为甲同学的方案中也
。沉淀而除去。”乙同学认为甲同学的方案中也
应该将溶液pH调至7-8。你认为乙同学的建议是否正确?________(填“是”或“否”),
理由是___________________________________________________________。
14.下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将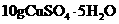 溶解在90g水中 溶解在90g水中 |
配制质量分数为10%的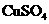 溶液 溶液 |
|
B |
向盛有1mL硝酸银溶液的试管中滴加KI溶液,至不再有沉淀,再向其中滴加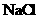 溶液 溶液 |
说明一种沉淀能转化为溶解度更小的沉淀 |
|
C |
在298K时,分别向2支试管中加入相同体积、相同浓度的HI溶液,再分别加入相同体积不同浓度的H2O2溶液 |
研究浓度对反应速率的影响 |
|
D |
室温下,测定浓度为 NaClO溶液和 NaClO溶液和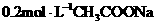 溶液的pH 溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
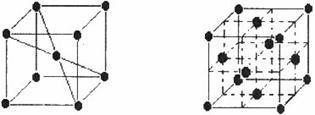

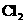 、
、 气体,现采用NA2SO3与70%的浓硫酸为原
气体,现采用NA2SO3与70%的浓硫酸为原
 、
、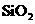 、
、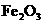 )是提取氧化铝的原料.提取氧化铝的
)是提取氧化铝的原料.提取氧化铝的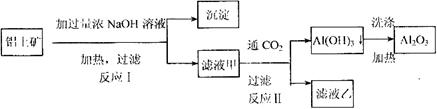
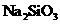 外还含有
外还含有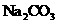 、
、 中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中
中的一种或两种,所含物质的质量分数都在5%以上。请设计合理实验探究该滤液乙中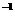 盐酸、2mol·L
盐酸、2mol·L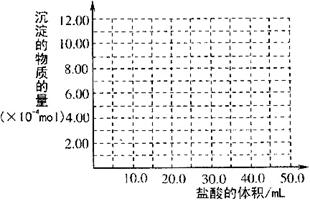 (4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L
(4)取(3)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L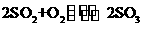 。
。 ,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是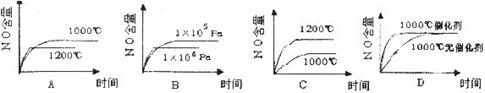
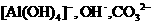 的溶液中逐滴加入盐酸:
的溶液中逐滴加入盐酸: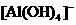 ,
,
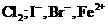
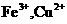 ,
,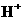 的溶液中逐渐加入锌粉:
的溶液中逐渐加入锌粉: