摘要:已知A.B.C.D.E.F都是周期表中前四周期的元素.它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子,化合物B2E的晶体为离子晶体.E原子核外的M层中只有两对成对电子,C元素是地壳中含量最高的金属元素,D单质的晶体类型在同周期的单质中没有相同的,F原子核外最外层电子数与B相同.其余各层电子均充满.请根据以上信息.回答下列问题:(答题时.A.B.C.D.E.F用所对应的元素符号表示) (1)A.B.C.D的第一电离能由小到大的顺序为 . (2)B的氯化物的熔点比D的氯化物的熔点 .理由是 . (3)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化.E的最高价氧化物分子的空间构型是 . (4)F的核外电子排布式是 .F的高价离子与A的简单氢化物形成的配离子的化学式为 . (5)A.F形成某种化合物的晶胞结构如右图所示.则其化学式为 , (6)A.C形成的化合物具有高沸点和高硬度.是一种新型无机非金属材料.则其化学式为 .其晶体中所含的化学键类型为 .
网址:http://m.1010jiajiao.com/timu3_id_66436[举报]
已知A、B、C、D、E、F都是周期表中前四周期的元素.它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出C原子的价层电子排布图
 ,F位于周期表
,F位于周期表
(2)A、B、C的第一电离能由小到大的顺序为
(3)F和质子数为25的M的部分电离能数据列于下表
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是
(4)晶胞中F原子的配位数为
g/cm3
g/cm3(用含r的表达式表示),该晶胞中原子空间利用率为
(5)H2S和C元素的氢化物(分子式为H2C2的主要物理性质比较如下
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因
查看习题详情和答案>>
(1)写出C原子的价层电子排布图


d
d
区.(2)A、B、C的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(写元素符号)(3)F和质子数为25的M的部分电离能数据列于下表
| 元素 | M | F | |
| 电离能(kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
Mn2+的3d轨道电子排布为半满状态较稳定
Mn2+的3d轨道电子排布为半满状态较稳定
.(4)晶胞中F原子的配位数为
8
8
,若F原子的半径为rcm,则F晶体的密度为| 112 | ||||
6.02×1023×(
|
| 112 | ||||
6.02×1023×(
|
68%
68%
.(5)H2S和C元素的氢化物(分子式为H2C2的主要物理性质比较如下
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 比任意比互溶 |
H2O2分子间存在氢键,与水分子可形成氢键
H2O2分子间存在氢键,与水分子可形成氢键
. 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)(1)A、B、C、D的第一电离能由小到大的顺序为
Na<Al<Si<N
Na<Al<Si<N
.(用元素符号表示)(2)B的氯化物的熔点比D的氯化物的熔点
高
高
(填高或低),理由是NaCl为离子晶体而SiCl4为分子晶体
NaCl为离子晶体而SiCl4为分子晶体
.(3)A的最高价氧化物对应的水化物分子中其中心原子采取
sp2
sp2
杂化,E的最高价氧化物分子的空间构型是平面正三角形
平面正三角形
.(4)F的核外电子排布式是
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
1s22s22p63s23p63d104s1(或[Ar]3d104s1)
,F的高价离子与A的简单氢化物形成的配离子的化学式为[Cu(NH3)4]2+
[Cu(NH3)4]2+
.(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为
Cu3N
Cu3N
;(每个球均表示1个原子)(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为
AlN
AlN
,其晶体中所含的化学键类型为共价键
共价键
.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C是同一周期相邻的三种元素,B、D、F元素原子最外电子层的p能级(轨道)上的电子均处于半满状态,元素E的最高正价氧化物的水化物在同周期元素的最高正价氧化物的水化物中酸性最强.
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为 (用对应的元素符号填空,下空同),三者的电负性由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是 .
(4)F元素原子基态时的核外电子排布式为 .
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为 ,X分子的中心原子的杂化轨道类型为 ,X与水反应的化学方程式是 .
(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为 .(用NA表示阿伏加德罗常数)
查看习题详情和答案>>
请回答下列问题:
(1)A、B、C三元素的第一电离能由大到小的顺序为
(2)A、B、C三元素的氢化物分子的空间结构分别是
(3)B、D、F三元素的氢化物的沸点从高到低排列次序是(填化学式)
(4)F元素原子基态时的核外电子排布式为
(5)由B、E两种元素组成的化合物X,常温下为易挥发的淡黄色液体,x分子为三角锥形分子,且分子里B、E两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质,则X分子的电子式为

(6)另有一种位于周期表中ds区的元素G,该元素单质形成的晶体晶胞如图所示,若假设该原子半径为r,相对原子质量为Mr,则该元素单质的密度可表示为
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A、B、C是同一周期的非金属元素.化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素是第四周期元素中未成对电子数最多的元素,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,1mol配合物与足量的AgNO3溶液反应能立即生成3molAgCl.F原子的一种核素的质量数为65,中子数为 36.请根据以上情况,回答下列问题:(答题时要用元素符号表示)
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是 .F元素原子的最外层电子数为 个.
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为 ;B3-离子还可以和一价阴离子互为等电子体,这阴离子电子式为 ,这种阴离子常用于检验日常生活中的一种金属阳离子,这金属阳离子符号为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是 ,ECl3形成的六配位的配合物化学式为 .
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如右图,F为 球(“黑”“白”)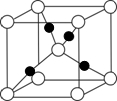
查看习题详情和答案>>
(1)B氢化物与HCl反应生成的含有B元素粒子的空间构型是
(2)B3-离子分别与AC2、由B、C组成的气态化合物互为等电子体,则B、C组成的化合物化学式为
(3)A、B、C的第一电离能由小到大的顺序为
(4)E3+的核外电子排布式是
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是
(6)在F的+1价氧化物的晶胞结构如右图,F为

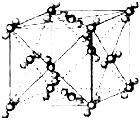 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为
(2)A、B、C的第一电离能由大到小的顺序为
(3)B元素的单质分子中有
(4)上述A的氧化物分子中心原子采取
(5)FH3沸点与比BH3
(6)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,实验将含0.2665gCrE3?6H2O的溶液通过H-离子交换树脂(只交换配阳离子),交换出的酸用0.125mol/L的氢氧化钠溶液8.00mL中和.已知配离子配位数为6,则该配离子是