20.(7)现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但有一种相同的化合价。它们的一些物理常数如下:
|
元素 |
A |
B |
C |
D |
|
原子半径/nm |
0.102 |
0.077 |
0.117 |
0.075 |
|
单质沸点/℃ |
444.6 |
4827 |
2355 |
-195.8 |
(1)A元素在元素周期表中的位置为 。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是
。
(3)含D元素的两种常见共价化合物发生化合反应可生成一种离子化合物,该反应的化学方程式为 。
(4)A、B、C、D均可形成分子中含18个电子的氢化物,这些氢化物的分子式为
(写出3种即可)。
k+s-5#u

18.(10分)有A、B、C、D、E、F六种原子序数依次增大的主族元素,其相关信息如下:
①短周期元素C原子的最外层有4个电子,E单质可在空气中燃烧;
|
C |
D |
E |
|
|
|
F |
②右表是元素周期表中的主族元素的一部分:
③A、B为同周期相邻金属元素,A原子最外层电子数是其电
子总数的1/6;据些回答下列问题:
(1)D的元素符号是 ,F在元素周期表中的位置为 ;
(2)C的最高价氧化物与烧碱溶液反应的离子方程式为 ;
(3)B、E两元素分别形成的简单离子在水溶液中发生反应的离子方程式为
。
13.下表数据是对应物质的熔点/℃
|
NaCl |
Na2O |
AlF3 |
AlCl3 |
BCl3 |
Al2O3 |
CO2 |
SiO2 |
|
801 |
920 |
1291 |
190 |
-109 |
2073 |
-57 |
1723 |
据此,下列判断错误的是: ( )
A.AlF3晶体与AlCl3晶体的晶体类型相同
B.BCl3与CO2晶态时,均属分子晶体,且BCl3与CO2均为非极性分子
C.同族元素的化合物可形成不同类型的晶体k+s-5#u

D.离子键的强弱与离子电荷的高低和半径的大小相关
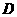 是由元素W、Y形成的常见化合物。w.w.w.k.s.5.u.c.o.m k+s-5#u
是由元素W、Y形成的常见化合物。w.w.w.k.s.5.u.c.o.m k+s-5#u
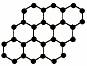 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是 ( )