3.实验室里需要配制480mL 0.10mol·L-1的硫酸铜溶液,下列实验方案及实验操作正确的是 ( )
|
|
容量瓶容积 |
溶质质量 |
实验操作 |
|
A |
480mL |
硫酸铜:7.68g |
加入 500mL水 |
|
B |
480mL |
胆矾:12.0g |
配成500mL溶液 |
|
C |
500mL |
硫酸铜:8.0g |
加入500mL水 |
|
D |
500mL |
胆矾:12.5g |
配成500mL溶液 |
18.(12分)碘酸钾是一种白色晶体粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物制质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氢酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:

6I2+11KClO3+3H2O
6KH(IO3)2+5KCl+3Cl2 k+s-5#u

试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为 ;
(2)步骤②中,用硝酸而不用HI,其原因可能是 ;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为 ;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有 ;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为: ;
(6)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是 。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
17.(12分)三氯化磷和五氯化磷的物理常数如下表。
|
|
熔点 |
沸点 |
|
三氯化磷 |
-122℃ |
76℃ |
|
五氯化磷 |
148℃ |
200℃分解 |
用下图所示装置(酒精灯、铁架台等未画出)制取三氯化磷,在俱支试管d中放入足量白磷,将Cl2迅速而又不间断地通入d中,氯气与白磷会发生反应,产生火焰。k+s-5#u

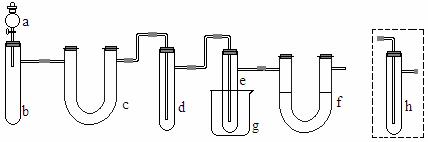
图中,a,b应该装入的试剂或药品分别是浓盐酸和二氧化锰,在b仪器处加热。请据此回答下列回答:
(1)在俱支试管e中收集生成的三氯化磷,为保证三氯化磷蒸气冷凝,应在烧杯g中加入 。
(2)三氯化磷遇到水蒸气强烈反应,甚至发生爆炸,所以d,e仪器及装入其中的物质都不能含有水分。为除去Cl2中的水分,c中应装入 作干燥剂。
(3)实验室将白磷保存于水中,取出的白磷用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻即可完全除去水分。解释用上述方法除去水分的原因是 。
(4)f装置中应装入
,目的是
。能否用h代替,为什么?
。k+s-5#u


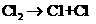 ②
②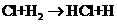
 ……
……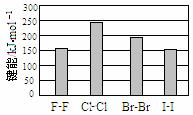 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断: