摘要:28.[Ar]3d64s2 金属 12 (3) 26B.下面是几种物质的溶解度数据: 物质 熔点(℃) 溶解度 物质 沸点(K) 20℃1atm时的溶解度 216.3 1.84 H2 20.3 0.00016 100 60.7 N2 77.35 0.0019 Cl2 239.1 0.72 溶剂状态 溶质状态 力的类型 力的大小 溶解结论 液态 固态 相似 F溶质>F溶剂 有限溶解 相异 难溶 液态 相似 F溶质≈F溶剂 互溶 相异 难溶 气态 相似 F溶质<F溶剂 有限溶解 相异 难溶 上述数据可以说明.结构相似的一类固体.在液体中的溶解度的规律是 , 结构相似的一类气体.在液体中的溶解度的规律是 . 固体和气体在液体中的溶解度呈现上述规律的原因是 . (2)①第四周期元素电子排布的能级能量由低到高依次为4s.3d.4p.第六周期元素电子排布的能级能量由低到高依次为: . ②若某元素价电子为3d74s2.则该元素位于元素周期表的第 周期. 族.原子序数为 .其原子的核外电子中成单电子有 个. 26B.固体的熔点越高.在液体中的溶解度越低.气体的沸点越高.在液体中的溶解度越高.中的分子间的作用力与液体中的分子间的作用力相近时.溶解度最大. ②四.3
网址:http://m.1010jiajiao.com/timu3_id_49300[举报]
 (2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.
(2013?江苏三模)研究证明,Fe、Fe2+、Fe3+易与CO、CN-等形成配合物.(1)配合物Fe(CO)5会使合成氨等生产过程中的催化剂中毒.
①Fe(CO)5中铁的化合价为0,写出铁原子基态的电子排布式:
1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
.该物质中含有的化学键类型有BD
BD
(填字母).A.离子键 B.极性共价键C.非极性共价键D.配位键
②常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断Fe(CO)5晶体的类型为
分子晶体
分子晶体
.(2)Fe、Fe2+都能被硝酸氧化.硝酸中氮原子轨道的杂化类型为
sp2
sp2
.(3)若向氯化铁溶液中加入少量的K4[Fe(CN)6]溶液,可生成蓝色沉淀KFe[Fe(CN)6],如图所示的是该晶体晶胞的八分之一(K+未画出).
①写出与CN-互为等电子体的一种分子的化学式:
N2
N2
.②该晶体的一个晶胞中含有的K+的个数为
4
4
.|
下列说法不正确的是 | |
| [ ] | |
A. |
电子云是笼罩在原子核外的云雾 |
B. |
下列电子排布式:1s22s12p1是某原子基态的排布式 |
C. |
任何能层中的d能级的轨道数都为5 |
D. |
[Ar]3d64s2表示的是Fe原子的电子排布式 |
(2011?太原二模)[化学--选物质结构与性质]
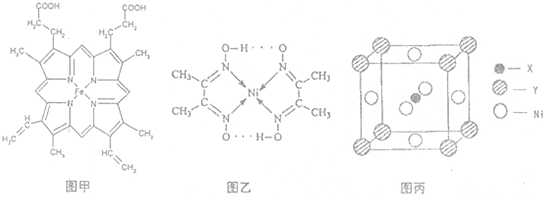
(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是
(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为
①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为
(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于
A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
查看习题详情和答案>>

(1)如图甲,血红素含有C、H、O、N、Fe五种元素,C、H、N、O四种元素的电负性由小到大的顺序是
H<C<N<O
H<C<N<O
,根据以上电负性请判断H2N-CHO中C和N的化合价分别为+2
+2
和-3
-3
.基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2
1s22s22p63s23p63d64s2或[Ar]3d64s2
.血红素中两种N原子的杂化方式分别为sp2
sp2
、sp3
sp3
.(2)卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.Cl2、IBr、ICl沸点由高到低的顺序为
BrI>ICl>Cl2
BrI>ICl>Cl2
.I+3(可看成II+2)属于多卤素阳离子,根据VSEPR模型推测I+3的空间构型为V形
V形
.多卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,则A的化学式为RbCl
RbCl
.①HClO4、②HIO4、③HIO6[可写成(HO)5IO]的酸性由强到弱的顺序为
①②③
①②③
(填序号).(3)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.配合物Ni(CO)4常温为流态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于
分子
分子
晶体.如图乙配合物分子内的作用力除共价键外,还存在的两种作用力是AD
AD
(填字母编号).A.氢键 B.离子键 C.范德华力 D.配位键
(4)最近发现,只含X、Y和Ni三种元素的某种晶体具有超导性.X元素原子的2p能级的电子排布图为
 ,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为
,Y元素原子的价电子排布式为3s2,该晶体的一个晶胞如图丙所示,则该晶体的化学式为MgCNi3
MgCNi3
. (2010?大连二模)[选修-物质结构与性质]
(2010?大连二模)[选修-物质结构与性质]羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中素.请回答下列问题:
(1)Fe(CO)5中铁的化合价为0,写出铁原子的基态电子排布式
[Ar]3d64s2
[Ar]3d64s2
.(2)CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO分子中C原子的杂化类型为
sp
sp
杂化.与CO分子互为等电子体的分子和离子各写出1种,分别为N2
N2
和CN-
CN-
(填化学式),CO分子的结构式可表示为C≡O
C≡O
.(3)Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体为
分子晶体
分子晶体
.(4)科学家通过X射线探明,FeO、MgO、CaO的晶体结构与NaCl的晶体结构相似(如图所示)①比较晶体熔点的高低MgO
高于
高于
CaO(填“高于”或“低于”)②若在FeO晶体中阴阳离子间最近距离为a cm,晶体密度为dg/cm3.则阿伏伽德罗常数NA表达式为
| 36 |
| da3 |
| 36 |
| da3 |
 铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂.
铁是地球表面最丰富的金属之一,能形成多种配合物,铁系催化剂是工业生产中常用的催化剂.(1)合成氨工业使用的催化剂是以铁为主体的多成分催化剂.
①NH3中N原子的杂化轨道类型是
sp3
sp3
.②N与O同属第二周期,N的第一电离能比O大的原因是
N原子失去的1个电子是相对稳定的半充满的2p能级上的电子,需要提供额外的能量,而O原子失去电子来自2p4构型,相对于2p3构型而言稳定性较差
N原子失去的1个电子是相对稳定的半充满的2p能级上的电子,需要提供额外的能量,而O原子失去电子来自2p4构型,相对于2p3构型而言稳定性较差
.③根据等电子体原理,写出一种和NH4+是等电子体的微粒的化学式
CH4
CH4
.(2)二茂铁[(C5H5)2Fe]是一种金属有机配合物,是燃料油的添加剂,
用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等.它的结构如图1所示,其中氢原子的化学环境完全相同.
①Fe的基态原子电子排布式为
[Ar]3d64s2或1s22s22p63s23p63d64s2
[Ar]3d64s2或1s22s22p63s23p63d64s2
.②二茂铁中Fe2+与环戊二烯离子(C5H5-)之间的化学键类型是
配位键
配位键
.③1mol环戊二烯(
 )中含有σ键的数目为
)中含有σ键的数目为11NA
11NA
个.(3)普鲁士蓝俗称铁蓝,结构如图2所示(K+未画出),每隔一个立方体在立方体中心含有一个K+离子,普鲁士蓝中铁元素的化合价有+2和+3两种,其中Fe3+与Fe2+的个数比为:
1:1
1:1
.