28. 乙酸乙酯是重要的工业原料和溶剂,通常混有少许乙醇和乙酸。某学习小组利用图1装置制取乙酸乙酯粗产品,再分析乙酸乙酯的含量。
|
|
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点 |
77.1℃ |
78.5℃ |
117.9℃ |
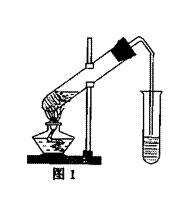
操作步骤如下:
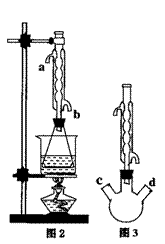 (I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L-1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol·L-1NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为40.0mL
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL 2.1mol·L-1NaOH溶液混合均匀后,装上冷凝箱,在水浴上加热回流约1小时,装置如图2所示。待冷却后,用0.50mol·L-1HCl滴定过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答下列问题:
(1)实验(II)中冷水从冷水凝管的 (填a或b)
管口通入。
(2)利用实验(I)、(II)测量的数据计算粗产物中乙酸
乙酯的质量分数为 。
(3)实验结束后,同学们对粗产品中乙酸乙酯的含量不高进行讨论。
①有人认为是实验(II)带来的误差。建议将图2中的锥形瓶改为三颈瓶,装置如图3,在三颈瓶的c、d口装配相关的仪器并进行恰当的操作,可以提高测定的精确度。你认为在三颈瓶的c、d口装配相关的仪器或操作是: (填字母);
A.装上温度计,严格控制反应温度
B.实验中经常打开瓶口,用玻璃棒进行搅拌
C.在反应后期,用事先安装的分液漏斗添加一定量的NaOH溶液
②还有同学认为改进乙酸乙酯的制取装置(图1)才能提高产率。拟出你的一条改进建议 ______________________________________________。
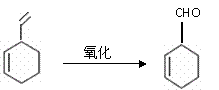
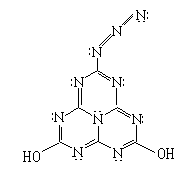 请你对这个结构作一番分析后,回答下列问题。
请你对这个结构作一番分析后,回答下列问题。
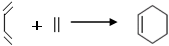


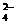

 HClO+OH-是酸碱反应
HClO+OH-是酸碱反应