1. 酸、碱、盐在水溶液中的电离
⑴.电离、电离方程式
① 电离:酸、碱、盐等溶于水或受热熔化时,离解成能够自由移动的离子的过程。
② 电离方程式:表示电解质电离的化学方程式。
⑵.电解质与非电解质的区别
|
|
电解质 |
非电解质 |
|
定义 |
在水溶液里或熔融状态下能导电的化合物 |
在水溶液里和熔融状态下都不导电的化合物 |
|
化合物类型 |
离子化合物(强碱、盐),强极性共价化合物 |
非极性共价化合物、弱极性共价化合物、大多数有机物 |
|
能否直接电离 |
溶于水或熔融时,直接能电离 |
溶于水或熔融时,不能直接导电 |
|
实例 |
H2SO4、HF、CaO等 |
SO3、NH3、CH4等 |
⑶.强弱电解质的区别
|
|
强电解质 |
弱电解质 |
|
|
相 同 点 |
都是电解质,在水溶液中都能电离,都能导电,与溶解度无关 |
||
|
不 同 点 |
电离程度 |
完全电离 |
部分电离 |
|
电离过程 |
不可逆过程 |
可逆过程,存在电离平衡 |
|
|
表示方法 |
电离方程式用“==” |
电离方程式用“ ” ” |
|
|
水溶液中微粒存在形式 |
电离出的阴、阳离子,不存在电解质分子 |
既有电离出的阴、阳离子,又有电解质分子 |
|
|
实 例 |
绝大多数盐:NaCl、BaSO4等。 强酸:H2SO4、HCl、HClO4等。 强碱:Ba(OH)2、Ca(OH)2等。 |
弱酸:H2CO3、CH3COOH等。 弱碱:NH3·H2O、Cu(OH)2等。 极少数盐。 |
2. 分散系及其分类
⑴ 定义:一种(或几种)物质以粒子形式分散到另一种物质里所形成的混合物。
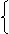 ⑵ 组成:分散质--被分散成微粒的物质
⑵ 组成:分散质--被分散成微粒的物质
分散剂--微粒分散在其中的物质
⑶ 分类:当分散剂是液体或水时,按分散质粒子的大小分类:
|
分散系 |
溶液 |
胶体 |
悬(乳)浊液 |
|
分散系粒子的直径 |
<1nm |
1nm-100nm |
>100nm |
|
分散质粒子的组成 |
小分子或离子 |
大分子或分子集合体 |
许多分子的集合体 |
|
外观 |
均一、透明 |
大多均一、透明 |
不均一、不透明 |
|
能否透过滤纸 |
能 |
能 |
一般不能 |
|
能否透过半透膜 |
能 |
不能 |
不能 |
|
实例 |
食盐水、糖水 |
淀粉胶体、Fe(OH)3胶体 |
泥水 |
⑷ 胶体
①胶体的制备:Fe(OH)3胶体的制备:___________________________
②胶体的性质
A:丁达尔效应:光束通过胶体,形成光亮的“通路”的现象
B:布朗运动:胶体分散质粒子作不停的、无秩序的运动的现象
C:电泳现象:在外加电场的作用下胶体微粒在分散剂里做定向移动的现象,叫做电泳。
D:胶体的聚沉:消除胶粒所带电荷,并使其凝集沉降的方法
方法 1.加电解质溶液(也称盐析):如盐卤点豆腐。
1. 简单分类法及其应用
⑴ 物质分类的方法
⑵ 化学反应分类的方法
① 四种基本反应类型
|
反应类型 |
举 例 |
表 示 式 |
|
化合反应 |
C+O2
 CO2 CO2 |
A+B==AB |
|
分解反应 |
CaCO3
 CaO+CO2↑ CaO+CO2↑ |
AB==A+B |
|
置换反应 |
C+CuO  Cu+CO↑ Cu+CO↑ |
A+BC==AC+B |
|
复分解反应 |
AgNO3+NaCl==AgCl↓+NaNO3 |
AB+CD==AD+CB |
② 根据化合价是否变化 -- 氧化还原反应和非氧化还原反应
③ 据反应中是否有离子参与 -- 离子反应和分子反应
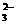 、S0
、S0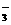 、HSO
、HSO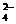 、CO
、CO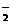 、SiO
、SiO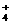 与OH-不能大量共存。
与OH-不能大量共存。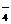 、NO
、NO