2、(1)
|
两组比较实验 |
观察到的实验现象 |
结论及解释 |
|
①比较有、无浓硫酸存在条件下酯化反应进行的快慢 |
有浓硫酸存在时反应较快,无浓硫酸存在时几乎不反应 |
酯化反应是可逆反应,浓硫酸既起到催化作用又起到吸水作用,有利于向酯化的方向进行 |
|
②比较在氢离子浓度相同的稀硫酸、稀盐酸作用下,酯化反应的快慢 |
反应速率几乎相等且都较慢 |
(2)小于。酯化反应是可逆反应,反应物无法全部转化成生成物。
(3)加入足量的浓硫酸和过量的乙醇。
(4)取三支试管各加入几滴乙酸乙酯,再分别加入等体积的蒸馏水、稀硫酸、氢氧化钠溶液,在70-80℃的水浴中加热几分钟,然后闻三支试管的气味。现象是:加蒸馏水的试管气味基本不变,加稀硫酸的试管还有一点气味,加氢氧化钠溶液的试管的气味几乎完全消失。结论:酯在酸或碱存在下能发生水解,在氢氧化钠存在时水解更彻底。分析:酯的水解反应是可逆过程,当加入碱时,水解生成的羧酸被碱中和,使反应彻底进行。
本资料由《七彩教育网》 提供!
2、设计实验,探究浓硫酸在生成乙酸乙酯反应中的作用
问题提出:①有浓硫酸存在条件下酯化反应是否进行得更快。②在不同的稀酸存在条件下酯化反应的快慢如何。
(1)某同学根据上述问题进行两组比较实验,请完成下表实验报告:
|
两组比较实验 |
观察到的实验现象 |
结论 |
|
①比较 |
|
|
|
②比较 |
|
|
(2)分别为1mol的乙酸和乙醇充分反应后,制得的乙酸乙酯 1mol,原因是
(3)要想提高乙酸的转化率,可采取那些措施?
(4)拓展实验:探究乙酸乙酯水解的最佳条件 (提示:比较酸性、中性、碱性条件下的水解。)。写出实验步骤、现象、结论并做出解释。
答案:1、(1)
(2)①减少晶体在洗涤时的溶解,②减少蒸馏水中溶解氧对晶体的氧化。
(3)①蒸干时溶液中的杂质离子会被带入晶体中,②蒸干时晶体会受热分解或被氧化。
(4)防止Fe2+被氧化成Fe3+。
(5)
步骤1.取少量晶体放入试管,用酒精灯加热。在试管口有液体生成,说明晶体中含有结晶水。
步骤2.取少量晶体配成溶液,将少量试样溶液分别加入到三支试管中。
(1)向第一支试管滴人2滴KSCN溶液,溶液不显红色。再向这支试管中加人几滴新配制的氯水(或H2O2)。溶液的颜色变为红色,说明有Fe3+存在,从而说明在原溶液中有Fe2+存在。
(2)向第二支试管加入浓NaOH溶液,加热,并在试管口用湿润的红色石蕊试纸检验。红色石蕊试纸变蓝,说明有NH3生成,确定在晶体中含有NH4+。
(3)向第三支试管滴入几滴用硝酸酸化的Ba(NO3)2溶液。有白色沉淀生成,说明在溶液中有SO42-存在。
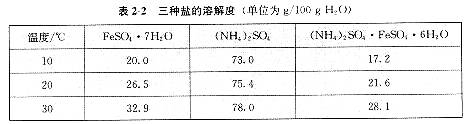
 。回答下列问题:
。回答下列问题: