摘要:27.实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4,FeSO4与(NH4)2SO4以等物质的量混合后加热.浓缩结晶得莫尔盐. (1)加热铁屑与稀硫酸时常常需要补充蒸馏水.原因是 . (2)实验中为减少硫酸亚铁的损失.过滤分离硫酸亚铁溶液时应注意的问题是 . (3)为防止Fe2+被氧化.实验中可采取的措施是 . (4)洗涤莫尔盐用无水乙醇而不用水.原因是 .
网址:http://m.1010jiajiao.com/timu3_id_405301[举报]
实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4;FeSO4与(NH4)2SO4以等物质的量混合后加热,浓缩结晶得莫尔盐。
(1)加热铁屑与稀硫酸时常常需要补充蒸馏水,原因是
________________________________________________________________________。
(2)实验中为减少硫酸亚铁的损失,过滤分离硫酸亚铁溶液时应注意的问题是________________________________________________________________________。
(3)为防止Fe2+被氧化,实验中可采取的措施是________________________________________________________________________
________________________________________________________________________。
查看习题详情和答案>>
实验室由铁屑制取莫尔盐的主要步骤是:由铁屑与稀硫酸水浴加热制取FeSO4;FeSO4与(NH4)2SO4以等物质的量混合后加热,浓缩结晶得莫尔盐。
(1)加热铁屑与稀硫酸时常常需要补充蒸馏水,原因是________。
(2)实验中为减少硫酸亚铁的损失,过滤分离硫酸亚铁溶液时应注意的问题是________。
(3)为防止Fe2+被氧化,实验中可采取的措施是________________。
查看习题详情和答案>>
硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |
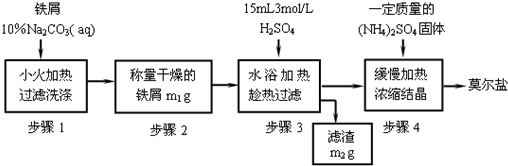
试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是______;反应中铁屑过量是为了______.
(2)步骤3需要趁热过滤,原因是______.
(3)从步骤4到莫尔盐,必须进行的操作依次是______,析出的晶体常用______洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是______(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式______.
(2)判断该反应到达滴定终点的现象为______.
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为______mol/L. 查看习题详情和答案>>
硫酸亚铁铵的化学式为(NH4)2SO4?FeSO4?6H2O,商品名为莫尔盐,可由硫酸亚铁与硫酸铵反应生成.一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了.三种盐的溶解度(单位为g/100g水)如下表:
(一)实验室制取少量莫尔盐的流程如图:
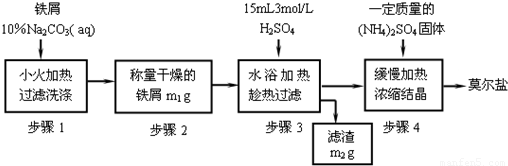
试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是______;反应中铁屑过量是为了______.
(2)步骤3需要趁热过滤,原因是______.
(3)从步骤4到莫尔盐,必须进行的操作依次是______,析出的晶体常用______洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是______(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式______.
(2)判断该反应到达滴定终点的现象为______.
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为______mol/L.
查看习题详情和答案>>
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

试回答下列问题:
(1)步骤1中加入10% Na2CO3溶液的主要作用是______;反应中铁屑过量是为了______.
(2)步骤3需要趁热过滤,原因是______.
(3)从步骤4到莫尔盐,必须进行的操作依次是______,析出的晶体常用______洗涤.
(4)若莫尔盐的饱和溶液中有水20克,当温度从30℃降至10℃,最多析出莫尔盐的质量是______(选填编号).
A.2.18g B.大于2.18g C.小于 2.18g D.无法确定
(二)称取质量为1.96g的莫尔盐制成溶液.用未知浓度的酸性KMnO4溶液进行滴定.
(1)已知MnO4-被还原为Mn2+,试写出该滴定反应的离子方程式______.
(2)判断该反应到达滴定终点的现象为______.
(3)假设到达滴定终点时,用去VmL酸性KMnO4溶液,则该酸性KMnO4溶液的浓度为______mol/L.
查看习题详情和答案>>
硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,商品名为莫尔盐。可由硫酸亚铁与硫酸铵反应生成硫酸亚铁铵,一般硫酸亚铁盐在空气中易被氧化,而形成莫尔盐后就比较稳定了。三种盐的溶解度(单位为g/100g水)如下表:
(一) 实验室制取少量莫尔盐的流程如下:

试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 17.2 | 26.4 | 33.0 | 46.0 | — | — |

试回答下列问题:
(1)步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,简述其除去油污的原理
(2)将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机
(3)步骤4中析出的晶体不含(NH4)2SO4和FeSO4的原因是 ,理论上制得的莫尔盐的质量为 。
(二)称取两份质量均为1.96g的该硫酸亚铁铵,制成溶液。用未知浓度的KMnO4酸性溶液进行滴定。
(1)滴定时,将KMnO4酸性溶液装在_______(填“酸式”或“碱式”)滴定管。试写出该滴定过程中的离子方程式:___ __;
(2)判断该反应到达滴定终点的现象为 ;
(3)假设到达滴定终点时,用去V mL KMnO4酸性溶液,则该KMnO4酸性溶液的浓度为 mol/L