摘要:盐的类型 实 例 参加电解物质 溶液pH 使溶液复原应加入物质 1. A-C盐 Na2SO4 KNO3 H2O 不变 H2O A的碱 KOH NaOH 增大 C的酸 H2SO4 HNO3 减小 2. B-D盐 CuCl2 HgCl2 电解质 不定 CuCl2.HgCl2 D的酸 HCl HBr 增大 HCl.HBr 3. A-D盐 NaCl KBr H2O+电解质 增大 HCl.HBr 4. B-C盐 CuSO4 AgNO3 减小 CuO.Ag2O 说明: ①阴阳离子在两极上放电顺序复杂.与离子性质.溶液浓度.电流强度.电极材料等都有关.不应将放电顺序绝对化.以上仅是一般规律. ②电解过程中析出的物质的量:在电解若干串联电解池中的溶液时.各阴极或阳极所通过的电量相等.析出物质的量取决于电路中通过的电量. 2.金属作阳极时.金属失电子发生氧化反应.阴极上阳离子放电顺序不变. 四.用惰性电极电解电解质溶液的变化情况 类 型 电极反应特点 实 例 电 解 物 质 电解质溶液的浓 度 pH 电解质溶 液复原 电解 水型 阴极:2H++2e-=H2↑ 阳极:4OH--4e-= O2↑+2H2O NaOH 水 增大 增大 水 H2SO4 水 增大 减小 水 Na2SO4 水 增大 不变 水 电解电解质 电解质电离出的阴.阳离子分别在两极放电 HCl 电解质 减小 增大 氯化氢 CuCl2 电解质 减小 增大 氯化铜 放H2生碱型 阴极:放出氢气生成碱 阳极:电解质阴离子放电 NaCl 电解质和水 生成新电解质 增大 氯化氢 放O2生酸型 阳极:OH-放电生成酸 阴极:电解质阳离子放电 CuSO4 电解质和水 生成新电解 质 减小 氧化铜 注意: (1)电解水型:含氧酸.强碱.活泼金属的含氧酸盐的电解, (2)电解电解质型无氧酸.不活泼金属的无氧酸盐溶液的电解, (3)放氢生碱型:活泼金属的无氧酸盐溶液的电解, (4)放氧生酸型:不活泼金属的含氧酸盐溶液的电解,
网址:http://m.1010jiajiao.com/timu3_id_395969[举报]
 离子反应是中学化学中重要的反应类型.回答下列问题:
离子反应是中学化学中重要的反应类型.回答下列问题:(1)在发生离子反应的反应物或生成物中,一定存在有
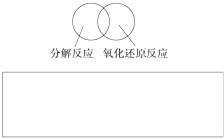
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示如图.请在方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-═H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
2- 4 |
①
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14.下列说法正确的是( )
查看习题详情和答案>>
(2012?延边州模拟)W、X、Y是原子序数依次增大的同一短周期元素.W、X是金属元素,它们的最高价氧化物的水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y可形成化合物W2Y.下列说法正确的是( )
查看习题详情和答案>>
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式
在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为
查看习题详情和答案>>
(1)在发生离子反应的反应物或生成物中,一定存在
③⑤
③⑤
.①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式
Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑
Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑
.在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为
H++HCO3-═H2O+CO2↑
H++HCO3-═H2O+CO2↑
.(8分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。


(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式_________________________在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
查看习题详情和答案>>