29、I、(5分).烧过菜的铁锅未及时洗净(残液中含NaCl),第二天便出现红棕色锈斑(该锈斑为Fe(OH)3失水的产物)。试用有关电极反应式、离子方程式和化学方程式表示Fe(OH)3的生成过程。
(1)负极:_______________________;
(2)正极:_______________________;
(3)离子方程式:_________________;
(4)化学方程式:_________________;
(5)总方程式:___________________。
Ⅱ(7分)、将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:

|
金属 |
电子流动方向 |
电压(V) |
|
A |
A→Cu |
+0.78 |
|
B |
Cu→B |
-0.15 |
|
C |
C→Cu |
+1.35 |
|
D |
D→Cu |
+0.30 |
已知:构成两电极的金属活泼性相差越大,电压表的读数越大。
请依据表中数据判断:
(1)______金属可能是最强的还原剂;______金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是________(填字母)金属。其对应的原电池的电极反应式为:
负极____________________________,正极______________________________。
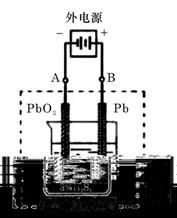 I、(06北京卷)(9分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是_________________________.
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
I、(06北京卷)(9分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________.
(2)铝与氢氧化钾溶液反应的离子方程式是_________________________.
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
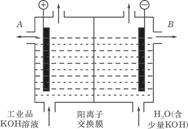 ①该电解槽的阳极反应式是____________________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因________________________
①该电解槽的阳极反应式是____________________________.
②通电开始后,阴极附近溶液pH会增大,请简述原因________________________ 2PbSO4+2H2O
2PbSO4+2H2O
 ,
, .
.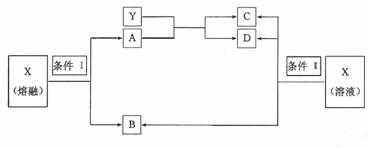 二、26(14分)已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示
二、26(14分)已知A、B、C、D、X、Y六种物质均由短周期元素组成,其中X为常见离子化合物,它们之间的转换关系如下图所示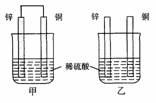 A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片是正极,乙中铜片是负极