网址:http://m.1010jiajiao.com/timu3_id_393765[举报]
(06年广东卷)某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4==Li2Mn2O4。下列说法正确的是()
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
查看习题详情和答案>>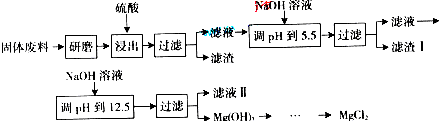
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣I的主要成分有
(3)从滤液Ⅱ中可回收利用的主要物质有
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
①粗盐和酸雨都是混合物;
②沼气和水蒸气都是可再生能源;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
上述说法正确的是( )
某工厂的废液经测定得知主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。现欲从废液中回收乙醇和乙酸,根据各物质的沸点,补充下列实验步骤,模拟实现这一过程,并回答有关问题。
|
物质 |
丙酮( |
乙酸乙酯 |
乙醇 |
乙酸 |
|
沸点/℃ |
56.2 |
77.06 |
78 |
117.2 |
可供选择的实验用品:
1 mol·L-1烧碱溶液,18.4 mol·L-1硫酸,蒸馏水和冰,400 mL烧杯,250 mL烧杯,250 mL蒸馏烧瓶,温度计,冷凝器,接收器,玻璃棒以及中学化学实验的常用仪器。
(1)补充下列实验步骤:
①组装蒸馏装置,检查气密性;
②取100 mL废液注入250 mL蒸馏烧瓶中,滴入1 mol·L-1烧碱溶液,调至废液pH=10;
③________________________________________________________________________;
④________________________________________________________________________;
⑤________________________________________________________________________;
⑥________________________________________________________________________。
(2)滴入1 mol·L-1烧碱溶液,使溶液的pH=10的目的是
________________________________________________________________________。
(3)用18.4 mol·L-1硫酸的目的是(用化学方程式表示)
________________________________________________________________________。
(4)最后蒸馏烧瓶内残留液中的溶质的主要成分是________。
查看习题详情和答案>>

(1)按图连接好实验装置.检查装置的气密性,方法是
(2)反应过程中末端导管必须插入试管A的水中,目的是
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,
(4)数据记录如下:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
| 14 |
| 5 |
| 14 |
| 5 |
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
| n(Ca) |
| n(N) |
| 3 |
| 2 |
| n(Ca) |
| n(N) |
| 3 |
| 2 |
 )
)