20、(15`)某小型化工厂生产皓矾(ZnSO4·7H2O)的工艺流程如下图所示:
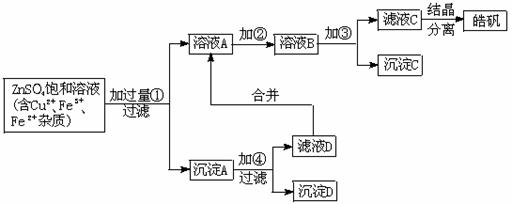
已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为:
Fe(OH)3:2.7-3.7 Fe(OH)2:7.6-9.6 Zn(OH)2:5.7-8.0
试回答下列有关问题:
(1)加入的试剂①应是 ,
其目的是 。
(2)加入的试剂②,供选择使用的有:氨水、NaClO溶液、20%的H2O2、浓硫酸、浓硝酸等,应选用 ,其理由是 。
(3)加入的试剂③是
的目的是 。
21(14`)、A、B、C、D均为短周期元素,A、B可形成两种液态化合物,其最简式分别为BA和B2A。A与D可形成气态化合物DA、DA2:A、B、D可组成离子晶体,该晶体的化学式为B4A3D2,其水溶液呈弱酸性:B与D可形成一种极易溶于水的碱性气体X,B与C可能形成极易溶于水的酸性气体Y,已知X分子与B2A分子中的电子数相等,Y分子中的电子数与最简式为BA的电子相等,请回答:
(1)写出四种元素的符号:A________ B________ C________ D________
(2)写出下列反应的化学方程式:
①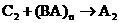 :________________________________
:________________________________
②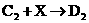 :________________________________
:________________________________
(3)B4A3D2的化学式为___________,其水溶液显酸性的离子方程式为_________________________________。
(4)已知液态X与B2A相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则X的电离方程式为__________________________。
22(14`)、不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在所形成的分子中成分为带负电荷的一方。
下面是某些短周期元素的x值:
|
元素符号 |
Li |
Be |
B |
C |
O |
F |
Na |
Al |
Si |
P |
S |
Cl |
|
x值 |
0.98 |
1.57 |
2.04 |
2.25 |
3.44 |
3.98 |
0.93 |
1.61 |
1.90 |
2.19 |
2.58 |
3.16 |
(1) 通过分析x值变化规律,确定Mg、N的x值范围:
<x(Mg)< , <x(N)< 。
(2)推测x值与原子半径的关系是 。据据短周期元素的x值变化特点,体现了元素性质的 变化规律。
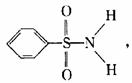
(3)某有机化合物结构式为: 其中S-N键中你认
为共用电子对偏向谁? (写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的x差值(Δx)即Δx>1.7时,一般为离子键,Δx<1.7,一般为共价键,试推断:AlBr3中化学键类型是 。
(5)预测元素周期表中,x值最小的元素的位置: (放射性元素除外)。
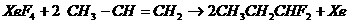 ,下列有关说法正确的是 ( )
,下列有关说法正确的是 ( )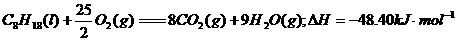
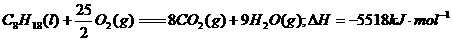
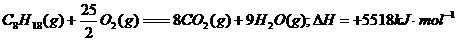
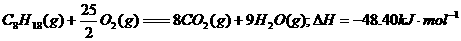
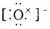 3.下列电子式中错误的是 ( )
3.下列电子式中错误的是 ( )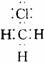
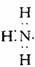 A.Na+ B.
A.Na+ B.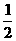 O2(g)==== H2O(l );△H= -285.8kJ/ mol
O2(g)==== H2O(l );△H= -285.8kJ/ mol