18.Fe3+和I-在水溶液中的反应如下:2I +2Fe
+2Fe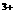
 2Fe
2Fe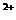 +I2(水溶液)。
+I2(水溶液)。
(1)该反应的平衡常数K的表达式为:K= 。当上述反应达到平衡后 ,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、 向左、不)。
(2)上述反应的正向反应速率和I 、Fe
、Fe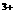 的浓度关系为:V=K[C(I-)]m[C (Fe
的浓度关系为:V=K[C(I-)]m[C (Fe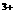 )]n(K为常数)
)]n(K为常数)
|
|
C (I )mol/L )mol/L |
C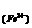 mol/L mol/L |
V(mol/L·S) |
|
(1) |
0.20 |
0.80 |
0.032K |
|
(2) |
0.60 |
0.40 |
0.144K |
|
(3) |
0.80 |
0.20 |
0.128K |
通过所给的数据计算得知:在V=K[C(I-)]m[C(Fe3+)]n 中mn的值为 。
A.m=1 n=1 B.m=1 n=2
C.m=2 n=1 D.m=2 n=2
I?-浓度对反应速率的影响 ,Fe3+浓度对反应速率的影响。(选填:大于、小于、等于)
知识点:本题是一信息试题。
能力点:培养学生自学能力,理解能力和应用能力。
 例:反应C(s)+H2O(g) CO(g)+H2(g)在可变容积的密闭容器中进行,下列的改变,对化学反应速率的影响如何?
例:反应C(s)+H2O(g) CO(g)+H2(g)在可变容积的密闭容器中进行,下列的改变,对化学反应速率的影响如何?
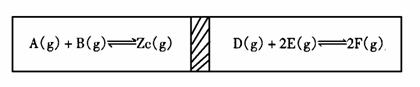 在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如下图所示的可逆 反应。各物质的起始加入量如下:A、B、C均为4.0mol,D为6.5mol,F为2.0mol。设E为Xmol。当X在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且
隔板恰好处于反应器的正中位置。请填写如下空白:
在一个容积固定的反应器中,有一个可左右滑动的隔板,两侧分别进行如下图所示的可逆 反应。各物质的起始加入量如下:A、B、C均为4.0mol,D为6.5mol,F为2.0mol。设E为Xmol。当X在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且
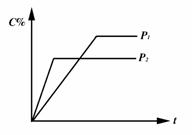
隔板恰好处于反应器的正中位置。请填写如下空白: 2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
2C(g)+2D(g)在四种不同情况下的反应速率分别为①VA=0.1 5mol/L·S②VB=0.6mol/L·S③VC=0.4mol/L·S④VD=0.45mol/L·S该反应进行的快慢顺序为
 知识点:本题考查有关化学平衡及其转化率的相关计算
知识点:本题考查有关化学平衡及其转化率的相关计算