19、(4分)已知气态氯化铝分子以双聚形式存在,其结构如下图所示:图中“Cl→Al”表示Cl原子提供
|
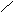



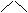
了一对电子与Al原子共享。又,已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。请写出下面这个方程式右端的两种离子的表达式:
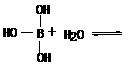
+
18、(10分)“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或pH值控制可参考下列附表确定。
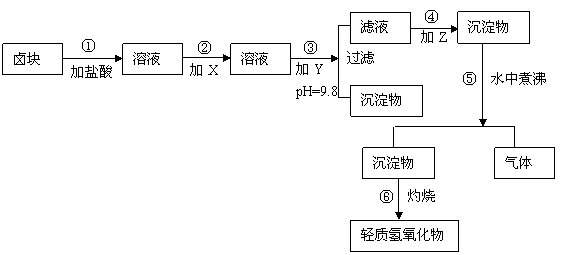
轻质氧化镁工艺流程图
表1 生成氢氧化物沉淀的值
|
物质 |
开始沉淀 |
沉淀完全 |
|
Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9.6 |
3.7 9.6Ω 9.8 11.1 |
Ω注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化成为Fe3+,生成Fe(OH)3沉淀而去除之。
表2 化学试剂价格表
|
试剂 |
价格(元/ t ) |
|
漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
请填写以下空白:
⑴在步骤②加入试剂X,最付佳选择应是 ,其作用是 。
⑵在步骤③加入的试剂Y应是 ,之所以要控制pH=9.8,其目的是 。
⑶在步骤⑤时发生的化学反应方程式是: 。
11、R2O8n-离子在一定条件下可以把Mn2+离子氧化为MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之为5:2,则的值是
A 1 B 2 C 3 D 4
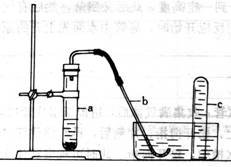 用示意图中的简易装置可以进行气体的发生和收集。
用示意图中的简易装置可以进行气体的发生和收集。