网址:http://m.1010jiajiao.com/timu3_id_352027[举报]
试完成下列问题:
(1)假如煤油成分之一A的分子中含有碳原子n(A)个,可能裂化为B和C两种烃,其分子中分别含碳原子n(B)和n(C)个,且B为烷烃。则下列组合中正确的是_____________________(填序号,多选或错选倒扣分)。
| n(A) n(B) n(C) |
a | 10 9 1 |
b | 11 6 5 |
c | 12 5 6 |
d | 13 9 3 |
e | 14 8 6 |
f | 15 11 4 |
(2)请写出上述b组所得到的烯烃中,主链上有4个碳原子的同分异构体的结构简式。
查看习题详情和答案>>(14分)实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表。
|
化合物 |
相对分子质量 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
74 |
0.80 |
118.0 |
9 |
|
冰醋酸 |
60 |
1.045 |
118.1 |
互溶 |
|
乙酸正丁酯 |
116 |
0.882 |
126.1 |
0.7 |
请回答有关问题。
Ⅰ.乙酸正丁酯粗产品的制备
在A中加入11.5mL正丁醇和7.2mL冰醋酸,再加3~4滴浓硫酸,混合均匀,投入沸石。如图所示安装分水器、温度计及回流冷凝管,并在分水器中预先加水至略低于支管口,加热回流,反应一段时间将水逐渐分去,至反应完毕。

(1)仪器A中发生反应的化学方程式为____________________________。有同学拟通过某种方法鉴定所得产物中是否含有杂质,可采用 确定。
a.红外光谱法 b.1H核磁共振谱法 c.质谱法
(2)“反应中利用分水器将水分去”该操作的目的是: 。
(3)反应时加热有利于提高酯的产率,但温度过高酯的产率反而降低,其可能的原因是 。
(4)可根据 现象来判断反应完毕。
Ⅱ.乙酸正丁酯粗产品的精制
(5)将仪器A中的液体转入分液漏斗中,用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是 。
(6)再用10ml 10%Na2CO3溶液洗涤有机层,该步操作的目的是 。
(7)将干燥后的产品蒸馏收集乙酸正丁酯产品时,应将温度控制在 左右。
查看习题详情和答案>>
(14分)(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值_______________(填“一定增大”“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物质的量浓度变化如下图(a)所示,则:
① 0-4min间平均反应速率v(CO)=________ mol??L-1??min-1
②在800℃时该反应的化学平衡常数K=___________________________(要求写出表达式及数值);CO的转化率=______________。
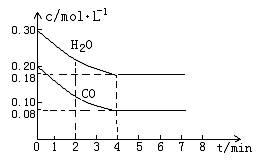
图(a)
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol/L和0.80 mol/L,则达到平衡时CO转化为CO2的转化率是:______________________。
(3)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列说法正确的是_______
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比, c(Mg2+)后者大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2固体在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2
E.25℃ 时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,则溶液的pH=9
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看习题详情和答案>>2001年9月11日,恐怖分子驾驶波音757飞机以900 km/h的速度撞击纽约世贸大厦,已知波音757飞机长80 m,总质量110 t,其中携带航空煤油30 t,煤油的燃烧值为4.62×104kJ/kg .航空煤油是石油分馏产品之一,其主要成分是分子中含碳原子个数10~15的烷烃.飞机撞击大厦时,煤油在燃烧爆炸所产生的高温条件下,有一部分迅速发生裂化,生成碳原子更少的烃,加剧了爆炸程度.
(1)假如煤油成分之一A的分子中含有碳原子nA个,可能裂化为B和C两种烃,其分子中分别含碳原子nB和nC个,且B为烷烃.则下列组合中正确的是________(填序号,多选或错选倒扣分).
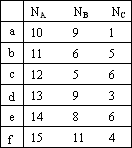
(2)请写出上述b组所得到的烯烃中,主链上有4个碳原子的同分异构体的结构简式________