1.数据分析、处理;图象分析;范围讨论。
[例题]在标准状况下,取甲、乙、丙各30.0 mL,相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化);
|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
255 |
385 |
459 |
|
气体体积/Ml |
280 |
336 |
336 |
请回答:
(1)甲组实验中,盐酸(选填“适量”“过量”或“不足量”,下同) ,乙组实验中盐酸 。
(2)盐酸的物质的量浓度为 ;
(3)合金中Mg、Al的物质的量之比为 ;
(4)丙实验之后,向容器中加入一定量1.00 mol·L-1 NaOH溶液,能使合金中的铝粉恰好完全溶解,再过滤出不溶性固体,求所得滤液中各溶质的物质的量浓度(要求写出计算过程)。
 [习题]HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示:
[习题]HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量关系如图所示:
|
|
 B
B
0 3.0 15 16.5 18.5 V(NaOH)(ml)
请回答:(1)与HNO3反应后Fe元素的化合价是 +3价 。
(2)纵坐标中A点数值是 0.008 mol ,B点数值是 0.016mol 。原HNO3的浓度是 0.72mol/L 。
[习题]a g Mg在盛有b L(标准状况)CO2和O2混合气体的密闭容器中燃烧。
(1)若反应容器中CO2有剩余,则容器内的固体物质中一定含有___________。
(2)若反应后容器中O2有剩余,则容器内固体的质量为___________,此时有b L CO2和O2的混合气体中O2的体积(VO2)必须满足的条件是_______________。
(3)若反应后容器中无气体剩余,则容器内固体物质的质量(m)的取值范围为___________。
答案:(1)MgO(3分) (2)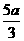 g(3分) b>VO2>
g(3分) b>VO2>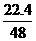 a (4分)
a (4分)
(3)(a+ ×32)<m<(a+
×32)<m<(a+ ×44) (4分)
×44) (4分)
 答案:(1)(C2H)n(H2O)m(3分)
答案:(1)(C2H)n(H2O)m(3分)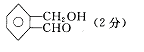 (2)C8H8O2
(2分) 6种 (2分)
(2)C8H8O2
(2分) 6种 (2分)
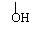 答案(1) CnH2nOn (2) ①HOCH2-CH2-COOH(或CH3-CH-COOH)
答案(1) CnH2nOn (2) ①HOCH2-CH2-COOH(或CH3-CH-COOH) ②H-C-O-CH2-CH2OH(或HO-CH2-C-O-CH3)
②H-C-O-CH2-CH2OH(或HO-CH2-C-O-CH3)
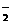 +H2O ②气体液化温度NO2 21℃;NO -152℃
+H2O ②气体液化温度NO2 21℃;NO -152℃
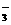 +2H2O(3分)
+2H2O(3分)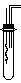 铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。
铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置。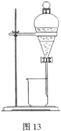 (3)依据图11所示,在萃取操作中应选取的有机溶剂为(多选不给分)_____________;
(3)依据图11所示,在萃取操作中应选取的有机溶剂为(多选不给分)_____________;