0 33340 33348 33354 33358 33364 33366 33370 33376 33378 33384 33390 33394 33396 33400 33406 33408 33414 33418 33420 33424 33426 33430 33432 33434 33435 33436 33438 33439 33440 33442 33444 33448 33450 33454 33456 33460 33466 33468 33474 33478 33480 33484 33490 33496 33498 33504 33508 33510 33516 33520 33526 33534 447348
 2C(气)+Q的正确图象是
2C(气)+Q的正确图象是


 c% 100℃ V V正
V V逆
V 500℃
c% 100℃ V V正
V V逆
V 500℃



 500℃ V逆 V正 100℃
500℃ V逆 V正 100℃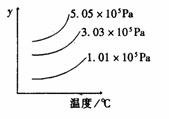 化学平衡图形题:
化学平衡图形题: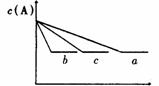 2 反应A(g)+B(g)===C(g)在密闭容器中进行。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 ,
2 反应A(g)+B(g)===C(g)在密闭容器中进行。若存在三种情况:①200℃,无催化剂;②500℃无催化剂;③500℃有催化剂;情况①是曲线 ,情况②是曲线 ,情况③是曲线 ,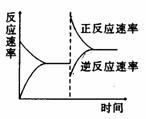 3 右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是
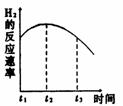
3 右图是关于反应A2(g)+3B2(g)===2C(g)(正反应为放热反应)的平衡移动图形,影响平衡移动的原因是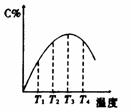 4 可逆反应A(g)+B(g)===2C(g)在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反应在 温度下达到平衡。⑵此反应的正反应为 热反应;⑶由T1向T2变化时正反应速率 逆反应速率(填>、<、=);⑷由T3向T4变化时正反应速率 逆反应速率(填>、<、=);
4 可逆反应A(g)+B(g)===2C(g)在不同的温度下经过一时间,混合物中C的体积分数与温度的关系如图所示,那么:⑴反应在 温度下达到平衡。⑵此反应的正反应为 热反应;⑶由T1向T2变化时正反应速率 逆反应速率(填>、<、=);⑷由T3向T4变化时正反应速率 逆反应速率(填>、<、=);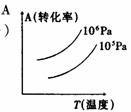 A 正反应是吸热反应,(m+n)>(p+q) B正反应是吸热反应,(m+n)<(p+q)
A 正反应是吸热反应,(m+n)>(p+q) B正反应是吸热反应,(m+n)<(p+q)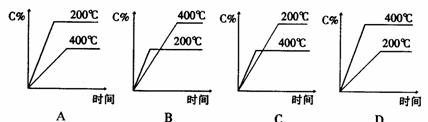
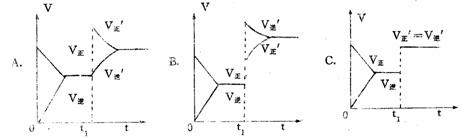
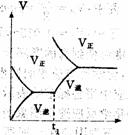 8 根据下列图象,推测相应改变的条件是( )
8 根据下列图象,推测相应改变的条件是( )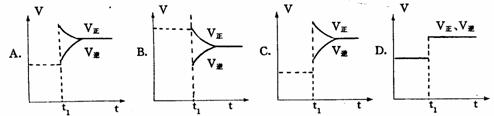 9 下列图象在t1时所对应的反应条件改变可能为:
9 下列图象在t1时所对应的反应条件改变可能为: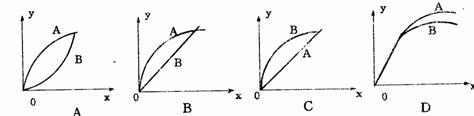
 下列图象在t1时所对应的反应条件改变可能为:
下列图象在t1时所对应的反应条件改变可能为: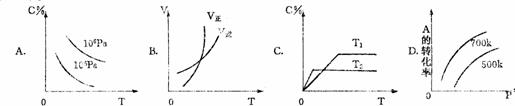
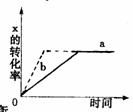 13 下图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是
13 下图中a曲线表示一定条件下可逆反应X(g)+Y(g)====2Z(g)+W(S)(正反应为放热反应)的反应过程。若使a曲线变为b曲线,可采用的措施是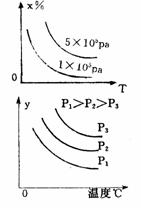
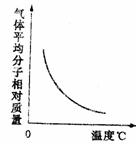 C G的转化率,正反应为放热反应 D R的分解率,正反应为放热反应
C G的转化率,正反应为放热反应 D R的分解率,正反应为放热反应 17 在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )
17 在密闭容器中进行下列反应:M(g)+N(g)==R(g)+2L。此反应符合下列图象,R%为R在平衡混合物中的体积分数,该反应是( )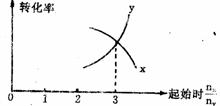 18 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如图所示,则X和Y的反应方程式可表示为( )
18 在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,达到平衡后,测得X,Y的转化率与起始时两物质的物质的量之比nx:ny的关系如图所示,则X和Y的反应方程式可表示为( )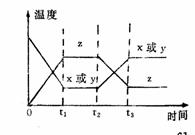 19今有X(g)+Y(g)====2Z(g)正反应为放热反应,从反应开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡。根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的
19今有X(g)+Y(g)====2Z(g)正反应为放热反应,从反应开始经过t1S后达到平衡状态t2S时,由于条件改变,平衡受到破坏,在t3S时又到平衡。根据右图回答:从t2S到t3S间的曲线变化是由哪种条件引起的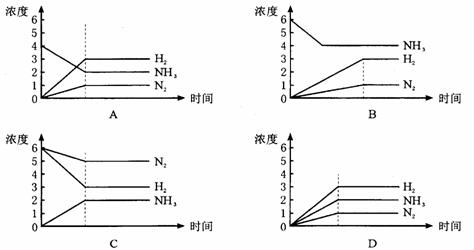 20下图表示反应:N2+3H2===2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是
20下图表示反应:N2+3H2===2NH3建立平衡的过程,如果用纵坐标表示物质的量浓度,横坐标表示时间来绘制这一反应的图形,则下列图形中一举正确的是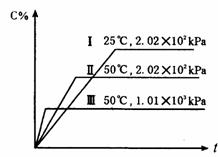 21在一密闭容器中进行如下反应:A(g)+B(g)====2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是
21在一密闭容器中进行如下反应:A(g)+B(g)====2C(g)+2D,此反应符合右图(其中C%是混合物中C的质量分数,t为反应时间)对此反应的叙述正确的是
 V A% c% 300℃ 浓度
V A% c% 300℃ 浓度



 V正 V逆
500℃ 100℃
D
V正 V逆
500℃ 100℃
D


 1×107Pa
1×107Pa
 温度 时间 压强 时间
温度 时间 压强 时间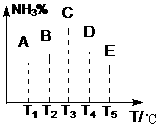 体积,发生反应N2 +H2
体积,发生反应N2 +H2 2NH3,并在第7秒时分别测定其中NH3的体积分数并绘成如图曲线。
2NH3,并在第7秒时分别测定其中NH3的体积分数并绘成如图曲线。