22.4 172
104 ×0.2% x
x=153.6kg
(2)如果将一定的尾气通人100mL2mol/L的NaOH溶液中使其完全反应,经测定所得溶液含16.7g溶质,试分析该溶液的成分,并计算各成分的物质的量。
答案:若溶液中溶质全部是Na2SO3:SO2+2NaOH=Na2SO3+H2O得12.6g
若溶液中溶质全部是NaHSO3:SO2+NaOH=NaHSO3得20.8g
今20.8g>16.7g>12.6g,该溶液成分为Na2SO3和NaHSO3,n(NaHSO3)=0.1mol,n(Na2SO3)=0.05mol
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3。调节尾气排放量,以取得SO2与NaOh间物质的量的最佳比值,从而提高NaHSO3 的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且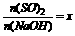 试写出x在不同的取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
试写出x在不同的取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
答案:
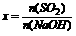 |
n(NaHSO3) |
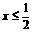 |
0 |
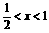 |
n(NaHSO3)=2n(SO2)-n(NaOH) |
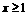 |
N(NaHSO3)=n(NaOH) |
15.现有氧化铜和炭粉的混合物共Amol,将它在隔绝空气的条件下加热。反应完全后冷却,得到残留固体。
(1)写出可能发生反应的化学方程式;
答案:(1)2CuO+C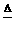 2Cu+CO2,CuO+C
2Cu+CO2,CuO+C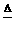 Cu+CO
Cu+CO
(2)若氧化铜在混合物中物质的量之比为x(0<x<1),问:当x为何值时,残留固体为何物?写出残留固体的物质的量与x值之间的关系,将结果填人下表:
|
x |
残留固体 |
|
化学式 |
物质的量 |
|
|
|
答案:
|
x |
残 留 固 体 |
|
|
化 学 式 |
物 质 的 量 |
|
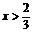 |
Cu、CuO |
2A(1-x)、A(3x-2) |
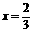 |
Cu |
Ax(或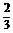 A) A) |
 |
Cu |
Ax |
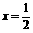 |
Cu |
Ax(或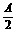 ) ) |
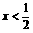 |
Cu、C |
Ax、A(1-2x) |
拓展练习
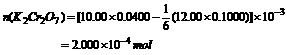
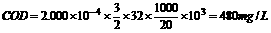
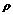 =1.18g/cm3)的盐酸与足量的MnO2反应,将生成的气体通入500mLNa2SO3溶液中,气体被吸收了90%,并同时收集到8.461L(标准状况下)混合气体。向该溶液中加入少量的4mol/L的BaCl2溶液200mL,过滤,再向溶液中加入足量的AgNO3九溶液,结果得到干燥的白色沉淀430.5g。试求:
=1.18g/cm3)的盐酸与足量的MnO2反应,将生成的气体通入500mLNa2SO3溶液中,气体被吸收了90%,并同时收集到8.461L(标准状况下)混合气体。向该溶液中加入少量的4mol/L的BaCl2溶液200mL,过滤,再向溶液中加入足量的AgNO3九溶液,结果得到干燥的白色沉淀430.5g。试求: mL,若乙组合金耗尽,应产生H2为
mL,若乙组合金耗尽,应产生H2为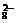 +2e-=2SO
+2e-=2SO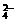 ,Mn2++4H2O=MnO
,Mn2++4H2O=MnO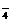 +8H++5e-,则氧化lmolMn2+需S2O
+8H++5e-,则氧化lmolMn2+需S2O