25、(10分)下表的实验数据是在不同温度和压强下,平衡混合物中NH3含量的变化情况。
达到平衡时平衡混合物中NH3的含量(体积分数)[ 入料V(N2)∶V(H2)=1∶3]
 NH3 压强/MPa NH3 压强/MPa的含量 /% 温度/℃ |
0.1 |
10 |
20 |
30 |
60 |
100 |
|
200℃ |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
|
300℃ |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
|
400℃ |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
|
500℃ |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
|
600℃ |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
(1)比较200℃和300℃时的数据,可判断升高温度,平衡向 方向移动,正反应方向为 反应。
(2)根据平衡移动原理,合成氨适宜的条件是 。
A 高温高压 B 高温低压 C 低温高压 D 低温低压
(3)计算500℃,30MPa时N2的转化率 。
(4)实际工业生产合成氨时,考虑浓度对化学平衡的影响,还采取了一些措施。请写出其中的一个措施: 。
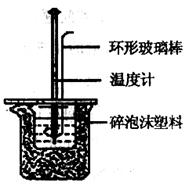 (8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(8分)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: zC达到平衡。
zC达到平衡。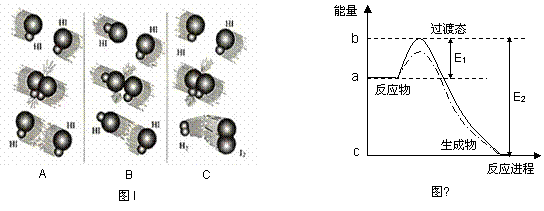 (2)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。
(2)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。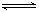 2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法:( )
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法:( ) 2NO2
(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是(
)
2NO2
(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是(
)