摘要: (1)化学反应可视为旧键断裂和新键形成的过程.化学键的键能是形成1 mol化学键时释放的能量.已知:N≡N键的键能是948.9kJ·mol-1.H-H键的键能是436.0 kJ·mol-1,由N2和H2合成1molNH3时可放出46.2kJ的热量.N-H键的键能是 . (2)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得.但可通过间接的方法测定.现根据下列3个热化学反应方程式: Fe2O3+3CO2(g) △H=-24.8 kJ·mol-1 3Fe2O3==2Fe3O4(s)+ CO2(g) △H=-47.2 kJ·mol-1 Fe3O4+CO2(g) △H=+640.5 kJ·mol-1 写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: .
网址:http://m.1010jiajiao.com/timu3_id_315369[举报]
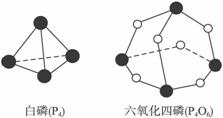
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示。现提供以下化学键的键能:P—P:198 kJ·mol-1,P—O:360 kJ·mol-1,O==O:498 kJ·mol-1。则反应:P4(白磷)+3O2====P4O6的反应热ΔH为
A.-1638 kJ·mol-1 B.+1638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
查看习题详情和答案>>
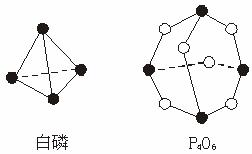
化学反应可视为旧键断裂和新键形成的过程。化学键键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如图所示。现提供以下化学键键能:P—P 198 kJ·mol-1、P—O 360 kJ·mol-1、氧气分子内氧原子间的键能为498 kJ·mol-1,则P4+3O2 P4O6的反应热ΔH为( )
P4O6的反应热ΔH为( )

A.+1 638 kJ·mol-1 B.-1 638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
查看习题详情和答案>>
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P—P 198 kJ·mol-1、P-O 360 kJ·mol-1、氧气分子内氧原子间的键能为498 kJ·mol-1,则P4+3O2 P4O6的反应热ΔH为( )
P4O6的反应热ΔH为( )
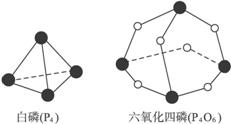
A.+1 638 kJ·mol-1 B.-1 638 kJ·mol-1
C.-126 kJ·mol-1 D.+126 kJ·mol-1
查看习题详情和答案>>