29.(14分)在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4)/mol/L |
0.100 |
c1 |
0.050 |
c3 |
c4 |
|
c(NO2)/mol/L |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为 ;从表中数据分析:c1 c2;c3 c4(填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线。
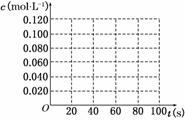
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为 mol/(L·s)。
(4)达平衡后下列条件的改变可使NO2气体浓度增大的是 。
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(5)其他条件不变,若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为 。
25.在0.1mol/L醋酸溶液中,要使醋酸的电离度和溶液的pH都减小,同时又使醋酸根离子浓度增大,可加入的试剂是( )
A.CH3COONa浓溶液 B.1mol/L氨水
C.1mol/L硫酸溶液 D.2mol/LCH3COOH溶液
|
20.从下列叙述中,能肯定判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变 B.反应物的转化率改变
C.正、逆反应速率改变 D.混合体系中气体密度发生改变
|
|
A |
B |
C |
D |
|
X/(mol·L-1) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y/(mol·L-1) |
0.04 |
0.12 |
0.09 |
0.03 |
 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是 ( )
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是 ( )  2SO3(g)△H=-QkJ·mol-1(Q>0)。下列说法正确的是 ( )
2SO3(g)△H=-QkJ·mol-1(Q>0)。下列说法正确的是 ( )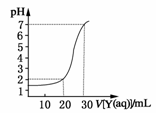 如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的 (
)
如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的 (
)