18、 实验室中配制250mL 0.20mo1·L-1NaOH溶液时,必须使用到的玻璃仪器是

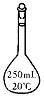 锥形瓶 试管 分液漏斗 容量瓶
A B C D
19、 不属于氧化还原反应的是
A、2Al+Fe2O3
锥形瓶 试管 分液漏斗 容量瓶
A B C D
19、 不属于氧化还原反应的是
A、2Al+Fe2O3 2Fe+Al2O3
B、2Mg+CO2
2Fe+Al2O3
B、2Mg+CO2 2MgO+C
C、N2+3H2
2MgO+C
C、N2+3H2 2NH3
D、SiO2+CaO
2NH3
D、SiO2+CaO CaSiO3
20、 在溶液中能大量共存的离子组是
A、H+、OH-、Na+ B、K+、NO3-、Cu2+
C、Ba2+、SO42-、Na+
D、Fe3+、OH-、NH4+
21、下列表达不科学的是
A.同周期元素,从左到右,原子半径逐渐减小,称有气体除外
CaSiO3
20、 在溶液中能大量共存的离子组是
A、H+、OH-、Na+ B、K+、NO3-、Cu2+
C、Ba2+、SO42-、Na+
D、Fe3+、OH-、NH4+
21、下列表达不科学的是
A.同周期元素,从左到右,原子半径逐渐减小,称有气体除外
B.酸性强弱:HClO4>H2SO4>H3PO4>H2SiO3 C.碱性强弱:NaOH <Mg(OH)2<Al(OH)3
D.同族元素,从上到下,原子半么逐渐增大 22、 下列四个试管中,过氧化氢分解产生氧气的反应速率最大的是
|
试管 |
温度 |
过氧化氢溶液浓度 |
催化剂 |
|
A |
常温 |
3% |
-- |
|
B |
水浴加热 |
3% |
-- |
|
C |
水浴加热 |
6% |
MnO2 |
|
D |
常温 |
6% |
-- |
[选择题答案填写处]
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
|
|
|
|
|
|
|
|
|
|
|
|
18. 某化学反应2A (g) ≒ B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol•L-1) 随反应时间 (min) 的变化情况如下表:
|
实验 序号 |
 浓度 浓度时间 温度 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
1.0 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1达到平衡的时间是 min,实验4达到平衡的时间是 min,C3 1.0 mol•L-1(填“ < ”、“ > ”或“ = ” )。
(2)实验4比实验1的反应速率 (填“快”或“慢”),原因是 。
(3)如果2A (g) ≒ B(g) + D(g) 是一个放热反应,那么实验4与实 验1相比, 放出的热量多,理由是 。
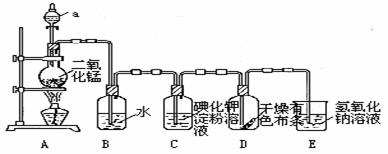
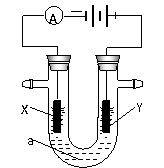 20电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
20电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
(3)若要在铁制品表面镀上一层银,则可选用 溶液为电解液,
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
17.完成下列表格的填写
|
电解对象 |
阳极反应式 |
阴极反应式 |
总反应式 |
|
氯化铜溶液 |
|
|
|
|
氢氧化钠溶液 |
|
|
|
|
盐酸 |
|
|
|
|
融熔氧化铝 |
|
|
|
|
硫酸钠溶液 |
|
|
|
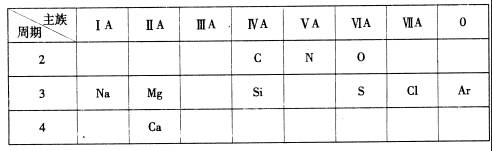 (1)金属性最强的元素是 (填元素名称);
(2)Ar原子结构示意图为 ;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C和N中,原子半径较小的是
;
(5)“高钙牛奶”中的钙是指
(填“元素”或“单质”);
(6)Si是带来人类文明的重要元素之一,其氧化物常用于制造 (填一种高性能的现代通讯材料的名称);
(7)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ________________________________________________
;
(8)O(氧元素)元素形成的一种氢化物的化学式是
,该物质中H元素与0元
(1)金属性最强的元素是 (填元素名称);
(2)Ar原子结构示意图为 ;
(3)第3周期元素中,最高价氧化物对应水化物酸性最强的是 (填化学式);
(4)C和N中,原子半径较小的是
;
(5)“高钙牛奶”中的钙是指
(填“元素”或“单质”);
(6)Si是带来人类文明的重要元素之一,其氧化物常用于制造 (填一种高性能的现代通讯材料的名称);
(7)镁是一种重要的金属材料,工业上采用电解熔融氯化镁获得金属镁,该反应的化学方程式为 ________________________________________________
;
(8)O(氧元素)元素形成的一种氢化物的化学式是
,该物质中H元素与0元

 2H2O+4H2O↑+O2↑ B、NaOH+HCl=NaCl+H2O
C、Fe2O3+6HCl=2FeCl3+3H2O D、2H2+O2
2H2O+4H2O↑+O2↑ B、NaOH+HCl=NaCl+H2O
C、Fe2O3+6HCl=2FeCl3+3H2O D、2H2+O2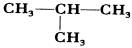 12、 下列关于能量转化的认识中,不正确的是
A.电解饱和食盐水时,电能转化为化学能
B.树木进行光合作用时,太阳能转化为化学能
C.汽油燃烧时,化学能转化为热能
D.电灯工作时,电能全部转化为光能
13、 右下图是某有机物的球棍模型,其中
12、 下列关于能量转化的认识中,不正确的是
A.电解饱和食盐水时,电能转化为化学能
B.树木进行光合作用时,太阳能转化为化学能
C.汽油燃烧时,化学能转化为热能
D.电灯工作时,电能全部转化为光能
13、 右下图是某有机物的球棍模型,其中 (代表氢原子,
(代表氢原子,
 代表碳原子,该有机物的名称是
代表碳原子,该有机物的名称是  A.乙烷[CH3CH3]
B.乙醇[CH3CH2OH] C.乙烯[CH2=CH2] D.乙酸[CH3COOH]
14、 暴露在空气中不易变质的是
A.钠 B.氧化钠 C.氯化钠 D.氢氧化钠
15、 随着科学技术的发展,新材料层出不穷。下列属于金属材料的是
A.生物陶瓷
B.钢化玻璃 C.钛合金
D.聚四氟乙烯
16、金属钠和纯水反应实验中,下列现象没有产生的是
A.产生气体
B.溶液充变红色
C.钠块熔化成银白色小球
D.银白色的小球浮在水面上
17、 下列各装置中,能构成原电池的是
A.乙烷[CH3CH3]
B.乙醇[CH3CH2OH] C.乙烯[CH2=CH2] D.乙酸[CH3COOH]
14、 暴露在空气中不易变质的是
A.钠 B.氧化钠 C.氯化钠 D.氢氧化钠
15、 随着科学技术的发展,新材料层出不穷。下列属于金属材料的是
A.生物陶瓷
B.钢化玻璃 C.钛合金
D.聚四氟乙烯
16、金属钠和纯水反应实验中,下列现象没有产生的是
A.产生气体
B.溶液充变红色
C.钠块熔化成银白色小球
D.银白色的小球浮在水面上
17、 下列各装置中,能构成原电池的是
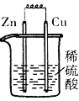
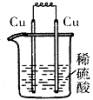
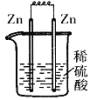
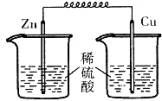 A B C D
A B C D
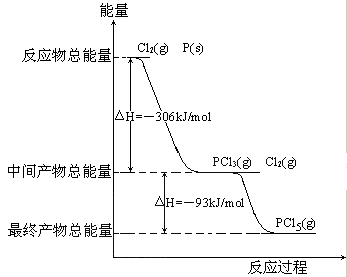
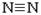 键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式:
键能为945kJ· mol-1,N-H键能为391kJ·mol-1。写出合成氨反应的热化学方程式: