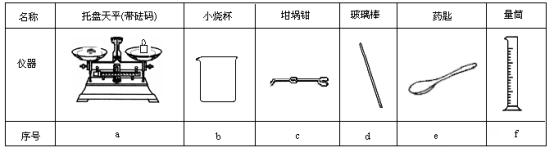
19.(18’)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。 Ⅰ.配制0.50 mol/L NaOH溶液 (1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。 (2)从图中选择称量NaOH固体所需要的仪器是(填字母): 。
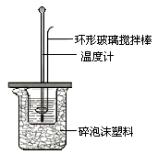
 Ⅱ.测定中和热的实验装置如图所示。
Ⅱ.测定中和热的实验装置如图所示。
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol): 。(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。 ①请填写下表中的空白:
|
实验次数 |
起始温度t1/℃ |
终止温度
t2/℃ |
温度差平均值
(t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。 ③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。 a.实验装置保温、隔热效果差 b.量取NaOH溶液的体积时仰视读数 c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中 d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
18、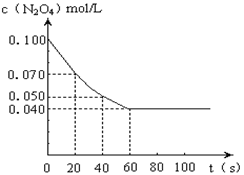 (9’)在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4
(9’)在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4  2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均
生成速率为 。
(2)该反应的化学平衡常数表达式为
。
(3)下表是不同温度下测定得到的该反应
的化学平衡常数。
|
T/ K |
323 |
373 |
|
K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2)是 反应(选填“吸热”或“放热”)
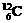 和
和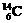 B.H2O和D2O
B.H2O和D2O CO(g)+H2(g) △H>0 试分析并回答下列问题:
CO(g)+H2(g) △H>0 试分析并回答下列问题: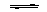 NH3·H2O
NH3·H2O  C(g)+D(g).5分钟后达到平衡.已知各物质的平衡浓度的关系为{C(A)a}×C(B)=C(C)×C(D),若在温度不变的情况下将容器的体积增大为原来的10倍,A的转化率不变,则B的转化率为( )
C(g)+D(g).5分钟后达到平衡.已知各物质的平衡浓度的关系为{C(A)a}×C(B)=C(C)×C(D),若在温度不变的情况下将容器的体积增大为原来的10倍,A的转化率不变,则B的转化率为( )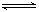 2C(g),若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法:
2C(g),若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法: xC(g),达平衡后C在平衡混合气中的体积分数为w,若维持温度和体积不变,按1.2molA、0.4molB、0.6molC为起始物质,达到平衡后,C的体积分数仍为w,则x值是( )
xC(g),达平衡后C在平衡混合气中的体积分数为w,若维持温度和体积不变,按1.2molA、0.4molB、0.6molC为起始物质,达到平衡后,C的体积分数仍为w,则x值是( )