21(12分). X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族,其中只有一种为金属,X的核外电子排布式为nsnnpn,Z的最外层电子数是其电子层数的2倍, Y原子与Z原子的最外层电子数之和为9,且Y和W单质都可与烧碱溶液反应,请回答以下问题:
(1)Y、Z、W的原子半径由大到小的顺序是 (填元素符号)
(2)XZ2的电子式是 ,空间结构为 ,
形成晶体时属于 晶体。
(3)Y的价电子排布式是 ,工业上生产单质Y的原理是________
((用化学反应方程式表示)
(4)试用勒夏特列原理解释用饱和食盐水收集W单质的原理
22.(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
A |
|
R |
|||||||||||||||
|
B |
|
|
|
C |
D |
E |
F |
T |
|||||||||
|
G |
H |
I |
J |
|
K |
L |
|
||||||||||
|
|
|
|
|
|
M |
|
N |
|
|
|
|
[来 |
|
|
|
|
|
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式 。
(2)D的气态氢化物的VSEPR模型为 ,其中心原子的杂化类型为__ _ _ __ 。
(3)G、H和I的第一电离能数值由大到小的顺序为: (用元素符号作答)。
(4)由A、C、D形成的ACD分子中,含有 个σ键, 个π键。
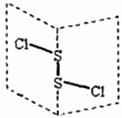
 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2。根据以上信息回答下列问题:
 下列说法错误的是(
)
下列说法错误的是(
)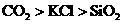 B.水溶性:
B.水溶性: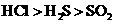
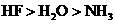
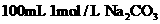 溶液中阴离子总数大于0.1NA
溶液中阴离子总数大于0.1NA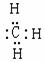
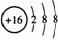
 2
AlN + 3 CO 下列叙述正确的是 ( )
2
AlN + 3 CO 下列叙述正确的是 ( )