17.(8分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
请回答下列问题:
⑴2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599kJ·mol-1,
则乙炔的燃烧热为 ▲ 。
⑵有些反应进行得很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难,此时可利用盖斯定律,就可以间接地把它们的反应热计算出来。已知
①CO(g)+1/2O2(g)=== CO2(g) ΔH1=-283.0kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1
则C(s)+1/2O2(g)=CO(g) ΔH = ▲ 。
⑶从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知键能数据如下表。
|
化学键 |
键能(kJ/mol) |
化学键 |
键能(kJ/mol) |
|
N≡N |
942 |
H-O |
460 |
|
N-H |
391 |
O=O |
499 |
|
H-H |
437 |
|
|
反应N2+3H2 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值 ▲ 。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a 的数值 ▲ 。
⑷最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。该方法既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,插入强碱溶液中,一个电极通入空气,另一电极通入氨气。其电池总反应为4NH3+3O2═2N2+6H2O。试写出负极电极反应式 ▲ 。
16.(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适于电器及其他许多工业使用,必须进行电解精炼。
⑴在精炼铜时,阳极减小的质量与阴极增加的质量是否相等 ▲ (填“是”或“否”);阳极下面沉积金属的成分主要是 ▲ 。
⑵在精炼铜的过程中,Cu2+浓度逐渐下降,c(Fe2+)、c(Zn2+)会逐渐 ▲ ,所以需要定时除去其中的Fe2+、Zn2+。甲同学设计了下列除杂方案I(见下图)。
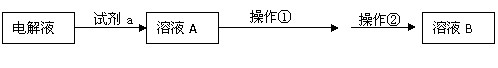
(方案I示意图)
请参照下表给出的数据,回答下列问题:
|
物 质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
|
开始沉淀时的pH |
7.6 |
5.2 |
2.7 |
8.0 |
|
完全沉淀时的pH |
9.6 |
6.7 |
3.7 |
11.0 |
①试剂a是 ▲ ,其目的是 ▲ 。
②操作①调节pH至b,b的取值范围是 ▲ 。
③调节溶液A的PH时可选择下列哪些试剂 ▲ 。
A.NaOH B.CuO C.Cu(OH)2 D.NH3·H2O E.Cu2(OH)2CO3
④操作②是 ▲ ,方案I中不能够除去的杂质金属阳离子是 ▲ 。
⑶乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节pH至7-8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的方案I中也应该将溶液pH调至7-8。
你认为乙同学的建议是否正确? ▲ (填“是”或“否”)理由是 ▲ 。
15.(12分)某草酸亚铁样品中含有少量硫酸亚铁。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5 Fe2+ +5C2O42-+3MnO4-+24H+==5 Fe3+ +10CO2↑+3Mn2++12H2O。
实验方案设计为:
①将准确称量的a g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用浓度为0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为b ml。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5-8min,经检验溶液合格后(不含Fe3+),继续用0.02000 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为c ml。
③ 。
④数据处理。
请回答下列问题:
⑴上述实验方案中的步骤③是 ▲ 。
⑵洁净的滴定管在滴定前必须进行的操作是:
Ⅰ、 ▲ ;
Ⅱ、用高锰酸钾标准溶液润洗滴定管;
Ⅲ、加入高锰酸钾标准溶液,赶走尖嘴部位的气泡;
Ⅳ、 ▲ 。
⑶步骤②中检验溶液是否合格的操作是:取1滴煮沸后的溶液滴入装有 ▲ 溶液的试管中,如 ▲ ,则说明溶液合格。
⑷某实验探究小组的一次测定数据记录如下:
|
a/g |
起始读数/mL |
b/mL |
c/mL |
|
0.1582 |
0.00 |
29.90 |
40.90 |
|
0.1582 |
0.00 |
30.10 |
41.10 |
|
0.1582 |
0.00 |
32.10 |
43.10 |
根据数据计算0.1582g 样品中:n(Fe2+)= ▲ ; n(C2O42-)= ▲ ;
FeC2O4(FeC2O4 的摩尔质量为144g/mol)的质量分数为 ▲ 。(精确到0.1%)
 Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0 及时移出
及时移出 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
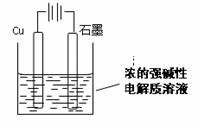 Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O Cu2O+H2
Cu2O+H2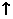 。下列说法正确的是
。下列说法正确的是 2CH3COO-+H2O+CO2↑
2CH3COO-+H2O+CO2↑