24.(11分)为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案。
已知:2Na2O2+2CO2=== 2Na2CO3+O2 2Na2O2+2H2O=== 4NaOH+O2
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度。
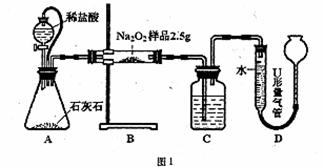
(1)C中所盛的药品是: 。
(2)A中橡皮管的作用是: 。
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是 (填选项字母)。
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙:称取3.500 g试样,配成1000.00 mL溶液,用0.1000 mol·L-1的标准盐酸滴定。
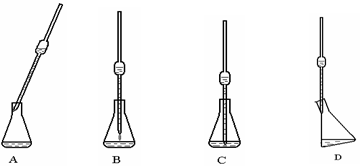
(4)取上述所配溶液25.00 mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图 ,取溶液所用仪器的名称是 。
(5)滴定操作平行实验的数据记录如下表:
|
滴定次数 |
第一次滴定 |
第二次滴定 |
第三次滴定 |
|
消耗标准盐酸的体积(mL) |
24.98 |
25.00 |
25.02 |
由表中数据计算样品中Na2O2纯度为 。
 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
 2NH3
(g) ΔH=-92.2kJ·mol-1
2NH3
(g) ΔH=-92.2kJ·mol-1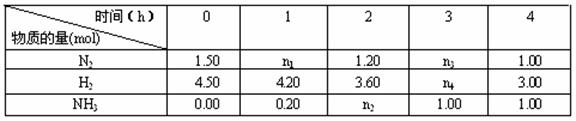
 乙+丙 B 乙
乙+丙 B 乙 -O-+CO2 +H2O→2
-O-+CO2 +H2O→2