20.(12分)在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g) 2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g), 已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
A.N2的转化率越高 B.NH3的产量越大
C.正反应进行得越彻底 D.化学反应速度越快
(3)a与b的关系是:a b(填>、<、=)
(4)填写下表:
|
状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
|
编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
|
恒容 |
① |
1 |
3 |
0 |
b |
|
② |
0 |
0 |
|
b |
|
|
③ |
|
2.25 |
|
b |
宿迁中学2009-2010学年度第二学期期中考试
19.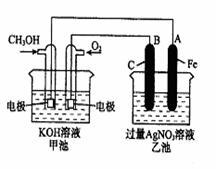 (12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
(12分)右图是一个化学过程的示意图。已知甲池的总反应式为:
|
(1)请回答图中甲、乙两池的名称。
甲电池是 装置,
乙池是 装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是 ,
B(石墨)电极的名称是 。
(3)写出电极反应式:
通入O2的电极的电极反应式是 。A(Fe)电极的电极反应式为
,
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
 O2+HbCO ,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是
O2+HbCO ,37 ℃时,该反应的平衡常数K=220
。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是 ( )
( )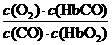
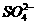 (aq)+
(aq)+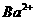 (aq)+2OH
(aq)+2OH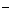 (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H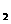 O(1);
O(1);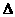 H=
H=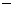 57.3 kJ/mol
57.3 kJ/mol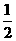 H
H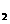 O(I);
O(I); 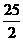 O
O 。下列说法正确的是 (
)
。下列说法正确的是 (
)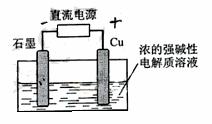 A.石墨电极上产生氢气
A.石墨电极上产生氢气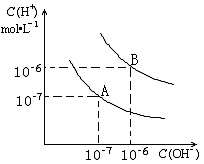 (1)则25 时水的电离平衡曲线应为 (填A或B)
(1)则25 时水的电离平衡曲线应为 (填A或B)